Claudio Jommi1, Marianna Cavazza1 e Carlo Federici1
1Gruppo di ricerca del CERGAS SDA Bocconi
Tendenze Nuove n.1 – 2018; 11-34: DOI: 10.32032/TENDENZE01201803.PDF
 Scarica Pdf
Scarica Pdf
Il presente paragrafo analizza la prima tematica oggetto della ricerca, ovvero il tema della prioritizzazione dell’offerta vaccinale e di due politiche, una collegata al tema delle prioritizzazione (accordi di rimborso condizionato), una legata alle scelte a livello regionale e locale in caso di presenza di vaccini diversi per lo stesso target (politiche sugli acquisti).
Nello specifico, il paragrafo è strutturato in quattro parti:
• una sintetica disamina dei criteri di prioritizzazione previsti dal PNPV 2017-2019 e dalle regioni;
• una prima proposta di framework di riferimento per la prioritizzazio- ne delle offerte vaccinali;
• la discussione delle policy di accordo di rimborso condizionato e degli acquisti;
• il risultato di interviste aperte a tre Regioni (Piemonte, Lombardia e Veneto) che si sono rilevate disponibili per (i) le integrazioni informative sulle politiche vaccinali regionali, (ii) una valutazione circa le prospettive sulle scelte di priorità in materia di vaccini, (iii) una valutazione circa le prospettive di applicazione degli accordi di rimborso condizionato e di revisione dei criteri di aggiudicazione delle offerte vaccinali a seguito dell’approvazione del nuovo Codice degli Appalti. Delle otto regioni in- terpellate (Piemonte, Liguria, Lombardia, Veneto, Emilia Romagna, To- scana, Basilicata e Sicilia), oltre a Piemonte, Lombardia e Veneto, Regione Liguria ha fornite indicazioni sugli effetti del nuovo Codice degli Appalti sui vaccini e sui Management Entry Agreements.
3.1 La prioritizzazione nel Piano Nazionale
di Prevenzione Vaccinale (PNPV) 2017-2019 e nei Piani Regionali di Prevenzione
L’introduzione e copertura pubblica delle nuove tecnologie sanitarie richiedono una valutazione del loro impatto, anche di tipo economico, ai ni di una corretta allocazione di risorse scarse e della gestione della loro sostenibilità nanziaria. È importante che anche per i programmi di pre- venzione vaccinale vengano adottati criteri di prioritizzazione il più possi- bile razionali e trasparenti e condivisi a livello nazionale.
Il PNPV 2017-2019 ha previsto un allargamento dell’offerta vaccinale, in parte anticipato da alcune esperienze regionali. La Legge Finanziaria per il 2017 prevede un nanziamento di 100 milioni di euro nel 2017, 127 milio- ni di euro nel 2018 e 186 milioni di euro a decorrere dal 2019 a titolo di concorso al rimborso alle Regioni per l’acquisto dei nuovi vaccini inseriti in calendario. Lo stesso piano esplicita la possibilità di costituire un fondo per:
• co nanziare le Regioni in dif coltà oggettive a garantire uniformità, equità e universalità dell’offerta su scala nazionale;
• moltiplicare i punti di accesso al sistema, con la collaborazione, ad esempio, delle associazioni di cittadini e di professionisti, delle ammini- strazioni scolastiche e della grande imprenditoria;
• garantire il progressivo inserimento della vaccinazione tra i compiti previsti nella struttura di convenzione nazionale della medicina conven- zionata, sia generalistica che pediatrica di libera scelta, d’accordo con le organizzazioni sindacali del settore.
Il PNPV 2017-2019 richiama:
• in termini prospettici l’utilizzo dell’HTA come strumento di raccolta delle migliori evidenze a supporto delle decisioni di allargare ulteriormen- te l’offerta vaccinale;
• diversi elementi propri di un HTA applicata ai vaccini.
Con riferimento al secondo punto di cui supra, viene richiamata:
• la rilevanza delle evidenze non solo di ef cacia, ma anche di qualità,
incluso il pro lo di sicurezza dei vaccini;
• la necessaria disponibilità di vaccini (evitando carenze di stock);
• l’opportunità di adottare nella valutazione di impatto del rischio evi-
tato una prospettiva sociale (costi diretti sanitari, costi diretti non sanitari e costi collegati alla perdita di produttività dei pazienti), dato l’impatto che la patologia ha sul sistema economico nel suo complesso, includendo non solo la perdita di produttività, ma gli effetti indiretti della stessa sulle entrate scali.
Sempre con riferimento all’HTA e nello speci co degli studi di impat- to, pur sottolineando i limiti informativi relativi ai costi della mancata pre- venzione (dati sulle coperture effettive – anagra vaccinali; effetti reali dell’immunità di gregge; dif coltà di stima della dimensione della perdita di produttività), vengono citati diversi esempi di studio sui costi evitati, e vengono proposte delle stime sui potenziali costi evitati dei vaccini per i quali è stata allargata l’offerta vaccinale.
Per quanto esistano diversi elementi propri dell’HTA richiamati dal PNPV:
• non risulta che il piano stesso offra un framework strutturato di valu- tazione ai ni della prioritizzazione delle nuove offerte vaccinali;
• presenta in alcune parti delle incompletezze informative che sono ovviamente comprensibili in un documento di programmazione naziona- le, ma che non dovrebbero essere presenti nelle attività di HTA, naliz- zate alla raccolta e sistematizzazione delle migliori evidenze disponibili.
A titolo esempli cativo, con riferimento all’estensione della copertura vaccinale HPV alla popolazione maschile:
• viene citato lo studio di Haeussler et al, 2015 che, utilizzando un approccio bayesiano, evidenzia valori di costo-ef cacia favorevoli;
• non viene citata la revisione sistematica effettuata da Ben Hadj Yahia MB, 2015 che mostra come tale vaccino non sia tendenzialmente costo-ef cacie se offerto alla popolazione maschile, se si considerano le patologie cui il vaccino speci camente risponde.
Si ricorda poi che a livello nazionale è stato istituito, con Circolare 1048/2 del 3/4/2017 del Ministero della Salute, il nuovo Gruppo Tecni- co Consultivo Nazionale sulle Vaccinazioni (NITAG, National Immuni- zation Technical Advisory Group), composto da Paolo Biasci (FIMP), Americo Cicchetti (Univ. Cattolica), Michele Conversano (ASL Taran- to), Fortunato D’Ancona (Ministero Salute), Patrizia Felicetti (AIFA), Lorenza Ferrara (Reg. Piemonte), Massimo Galli (Università di Milano), Sandro Giuffrida (Regione Calabria), Raniero Guerra (Ministero della Salute), Stefania Iannazzo (Ministero della Salute), Tommasa Maio (FIMMG), Lorenzo Montrasio (AIFA), Carlo Pini (ISS), Giovanni Rez- za (ISS), Alessandro Rossi (SIMG), Carlo Signorelli (Università di Par- ma), Antonietta Spadea (Regione Lazio), Paola Stefanelli (ISS), Elena Bozzola (Ospedale Bambino Gesù). Le informazioni sulle attività di tale gruppo sono ancora limitate, ma non sembra che tale Gruppo Tecnico abbia un ruolo nel supportare la valutazione delle nuove offerte vaccina- li. Nella prima riunione del 25/9/2017 sono state affrontate alcune que- stioni amministrative e la discussione su un documento per il recupero degli inadempimenti alle vaccinazioni obbligatorie.
A livello regionale, nei Piani Regionali di Prevenzione (PRP), analizzati per le 8 Regioni coinvolte nel progetto “Valore in Prevenzione” (Piemonte, Liguria, Lombardia, Veneto, Emilia R, Toscana, Basilicata, Sicilia), non sono citati interventi strutturati di valutazione. L’applicazione di una semplice ‘Content Analysis’ evidenzia come raramente si trovino esplicitamente citati HTA e costo-ef cacia ed il tema delle priorità è espressamente riferito al Piano Nazionale di Prevenzione (PNP) e non ad interventi regionali sul tema.
L’unica Regione ad avere citato esplicitamente nel proprio piano unframework di valutazione, integrato con un modello decisionale, delle nuove offerte vaccinali (non inserite formalmente nei LEA) è stata Regio- ne Lombardia, in coerenza con l’approccio:
• GRADE (Grading of Recommendations Assessment, Development and Evaluation) nella valutazione della qualità delle prove e decisione ba- sate sull’evidenza;
• DECIDE (Developing and Evaluating Communication Strategies to Support Informed Decisions and Practice Based on Evidence) nella for- mulazione di raccomandazioni.
Il modello lombardo prevede tre fasi:
1. prioritizzazione da parte della Regione Lombardia di quesiti rilevan- ti a partire anche da segnalazioni del territorio (aziende sanitarie, società scienti che, ecc.);
2. istruttoria, qualora non esista un dossier completo dell’Istituto Su- periore Sanità o indicazioni ministeriali sul tema, affidata, attraverso bando, ad un soggetto terzo (“Organo tecnico-scientifico vaccini) avente competenze di tipo metodologico, statistico epidemiologico ed economico e che deve garantire indipendenza da possibili con itti di interesse rispetto al vaccino considerato (tale attività è stata af data all’Università degli Studi di Milano per il 2017). Nello specifico l’istruttoria si riferisce a sei domini, cui corrispondono diversi indicatori individuati attraverso una consultazione mediante metodica Delphi (Gonzalez-Lorenzo et al. 2015 – cfr. infra):
• impatto della malattia;
• caratteristiche del vaccino;
• valori e preferenze;
• uso delle risorse;
• equità;
• fattibilità.
3. valutazione dell’istruttoria da parte di un panel multidisciplinare, comprendente rappresentanti del mondo dell’Università, delle Società scienti che, delle Associazioni dei Pazienti, della Sanità Pubblica e degli enti del Servizio Sanitario Regionale. Il panel, attraverso un processo di condivisione coordinato dall’Organo tecnico-scientifico vaccini, ha il com- pito di sviluppare il grading delle prove di efficacia e la loro valutazione di qualità utilizzando il metodo GRADE e formulare le raccomandazioni uti- lizzando il metodo DECIDE (parere favorevole, sfavorevole o condiziona- le alla nuova strategia).Esistono tuttavia diversi documenti regionali, normalmente associati ad autonome decisioni di allargare o prioritizzare l’offerta vaccinale rispetto alla programmazione nazionale, che non sono stati sistematicamente analiz- zati, se non a seguito di quanto emerso dalle interviste (cfr. infra) in quanto non sempre facilmente individuabili, raramente pubblicati sui relativi siti, in genere non riferiti espressamente ad un processo strutturato di valutazione delle evidenze ai ni dell’espansione (o prioritizzazione) dell’offerta vaccina- le a livello nazionale. Un esempio è rappresentato dal Decreto Assessorile 38/2015 di Regione Sicilia, con cui viene prevista l’offerta gratuita del vaccino anti-meningococco di tipo B e l’estensione del vaccino anti-HPV alla popolazione maschile, supportata da una serie di evidenze citate nel docu-mento, ma non riferite ad un framework strutturato.Le interviste regionali (cfr. infra) hanno però fatto emergere come la manca- ta formalizzazione di un framework non sia necessariamente sintomo dell’assenza di tale framework. Un esempio è quello della Regione Veneto, che di fatto, pur non avendo formalizzato un framework nel PRP, presenta un approccio e processo strutturato alla valutazione delle nuove offerte vaccinali (cfr. infra)
3.2. Quale possibile framework per la prioritizzazione in futuro
È evidente che esistono diversi casi in cui le nostre istituzioni hanno implicitamente utilizzato un approccio strutturato alla valutazione delle nuove offerte di vaccini ed alla relativa adozione, ma ad oggi non sembra esistere un framework di riferimento a livello nazionale.
Una revisione non sistematica di letteratura è stata effettuata attraverso Medline (via Web of Science), Pubmed e Embase, dal 2000 al 2016, utilizzando i termini:
“TI = (immuniz* OR immunis* OR vaccin*) AND TS=(strateg* OR polic* OR program* OR plan*) AND TS=(priorit* OR priority NEAR/2 setting OR recommendation* OR guideline* OR criteria* OR decision NEAR/2 making)”
Per coprire studi pubblicati in italiano sono state considerate anche le riviste Politiche Sanitarie; Epidemiology Biostatistics and Public Health (past Italian Journal of Public Health); GRHTA; Mecosan; Pharmacoecono- mics Italian Research Articles dal 2011 al 2016.
Sono stati anche consultati i siti delle principali organizzazioni interna- zionali che si occupano di attività di HTA (INAHTA; International Net- work of Agencies for Health Technology Assessment; EUnetHTA, Europe- an network for Health Technology Assessment; ISPOR, International Society for Pharmacoeconomics and Outcome Research).
Con riferimento alla letteratura scienti ca, avendo escluso le duplica- zioni, sono stati individuati 5969 titoli e, tra questi, 24 studi sono stati se- lezionati come studi di alta priorità per l’analisi. Di questi:
• 7 si riferiscono a contesti nazionali (Canada, USA, Paesi Bassi, Giappone e Italia);
• 3 sono studi di analisi comparativa tra Paesi;
• 10 studi forniscono framework metodologici / teorici sul tema della prioritizzazione dei vaccini;
• 4 studi sono revisioni di letteratura.
Gli studi di revisione tracciati coprono di fatto l’obiettivo originale dell’analisi e l’ultima revisione effettuata (Gonzalez-Lorenzo et al, 2015) include le evidenze delle revisioni precedenti ed è stato quindi considerato un primo importante riferimento per l’identi cazione di un framework di prioritizzazione (cfr. infra).
Con riferimento ai contributi teorici sull’uso dell’HTA, un recentepaper pubblicato su GRHTA (Gasparini et al, 2014) evidenzia come i domini fondamentali dell’HTA applicati ai vaccini non siano sostanzial- mente diversi da altre tecnologie, ma presentino alcuni peculiarità speci- che. Tali domini possono essere ricondotti:
• alla patologia target (non solo incidenza, prevalenza, mortalità, qualità della vita, costo sociale e sua composizione, ma anche popolazione a rischio e modalità di contagio della patologia);
• alle evidenze su sicurezza, ef cacia e tollerabilità, indagate attraverso studi sperimentali integrati da studi in real life ed eventualmente sintetiz- zate in revisioni sistematiche e metanalisi;
• ai modelli epidemiologici, nalizzati a simulare l’impatto delle vacci- nazioni (modelli di coorte, modelli dinamici e modelli ibridi);
• agli studi di costo-efficacia, nalizzati ad evidenziare la coerenza tra costi e bene ci incrementali derivanti da un determinato programma vaccinale;
• alla valutazione di impatto sulla spesa, ovvero una stima della spesa incrementale netta (o decrementale) generata dall’introduzione del vacci- no, che risente però dell’orizzonte temporale tipicamente breve delle valu- tazioni di impatto sul budget;
• alle questioni etiche, quali la dimensione dell’obbligo vaccinale, le esternalità positive – ovvero i vantaggi del vaccino sull’immunità di altre persone, l’equità di accesso;
• all’impatto organizzativo, per il quale assume rilevanza, tra gli altri aspetti, l’informazione alla popolazione.
In letteratura “grigia” si sono rintracciati due importanti punti di ri- ferimento. Il primo è rappresentato dall’HTA Core Model di EUnetHTA. Tale framework non ha però investigato nello speci co le peculiarità ap- plicative dell’HTA ai vaccini. Non esistono poi, a nostra conoscenza, stu- di pilota completi sui vaccini (esiste solo un pilota di una valutazione rapida di ef cacia comparativa per Zostavax® per la prevenzione di Herpes Zoster).
Il secondo è rappresentato da gruppi di interesse sull’HTA applicato ai vaccini. Nello speci co, sono stati creati due gruppi di lavoro in sede di:• HTAi (HTAi Interest Group on Assessment of Vaccination Programs), che non ha prodotto ad oggi documenti speci ci essendo stato costituito
da poco tempo;1
• ISPOR (Economic Evaluation of Vaccines Designed to Prevent Infec-
tious Disease: Good Practices Task Force), nalizzato a produrre raccoman- dazioni sulla valutazione economica dei vaccini, componente di una valu- tazione HTA. Il draft del documento oggi disponibile2:
- richiama le problematiche attuali delle analisi costo-ef cacia ap- plicate ai vaccini (ad esempio: prevalenza di metodi indiretti di valutazione della qualità della vita che non catturano i bene ci sot- to il pro lo psicologico della mancata esposizione al rischio; assen- za di valutazioni sugli effetti differenziali che il guadagno di salute e di riduzione del rischio hanno su famiglie con diverso reddito), che hanno portato:
- – anche in Paesi in cui la costo-efficacia è utilizzata in modo siste- matico come criterio di prioritizzazione, a utilizzare approcci più semplici di valutazione delle implicazioni economiche dei vaccini (ad esempio, l’uso del costo per caso di malattia evitato, criterio adottato dalla Joint Committee on Vaccination and Immunisation in UK);
- – i ricercatorino (i) a sviluppare sistemi più avanzati di analisi di costo- efficacia, quali la Extended Cost-Effectiveness Analysis che incorpora gli effetti differenziali dei vaccini sulle famiglie caratterizzate da diverso reddito, (ii) a utilizzare l’analisi di costo-beneficio in cui anche i bene ci vengono monetizzati;
- richiama l’opportunità di integrare i diversi approcci adottati/adot- tabili nella valutazione di impatto economico dei vaccini:
- – analisi tradizionale di costo-efficacia con eventuali valori-soglia alrapporto incrementale di costo-efficacia;
- – modelli di ottimizzazione sotto vincoli;
- – modelli di valutazione del ritorno dell’investimento pubblico (coninclusione delle entrate fiscali generate dal una maggiore produttività);
- fornisce delle raccomandazioni sulle tre tipologie di analisi sopra spe-cificate.
Alle evidenze di letteratura scienti ca ed alle iniziative di network diesperti in seno alle organizzazioni internazionali di HTA, si aggiungono le esperienze concrete di applicazione di HTA ai vaccini. A questo proposito sono ben sette gli studi di HTA su vaccini condotti (e/o coordinati) dall’I- stituto di Igiene dell’Università Cattolica e pubblicati come Quaderni sul sito dell’Italian Journal of Public Health3.I contributi sopra esplicitati hanno il merito di adottare approcci rigorosi nella produzione e/o raccolta di evidenze a supporto delle scelte e di - discutere in modo costruttivo le problematiche di applicazione dell’HTA (o di sue dimensioni come la valutazione economica) ai vaccini, ma:
• non rendono operativi i domini de niti a supporto delle scelte;
• non propongono dei sistemi di ranking di tali domini (quali sono i fattori più rilevanti per le decisioni?) e di eventuali sistemi di composizio- ne dei domini stessi;
• non risolvono, per loro natura, la questione della governance dei pro- cessi decisionali.
Da alcuni anni, a questo proposito è emerso un tentativo di struttu- rare il processo decisionale basato su criteri multipli attraverso l’approc- cio MCDA (Multiple Criteria Decision Analysis). L’interesse crescente è testimoniato dalla recente pubblicazione di due documenti della “MCDA ISPOR Emerging Good Practices Task Force” (Marsh et al, 2016; Thoka- la et al, 2016). Nonostante l’interesse per tale approccio il suo uso è an- cora molto limitato, in generale e nello speci co con riferimento ai vac- cini (Timmis et al, 2017):
• per la dif coltà intrinseca di adottare approcci totalmente trasparen- ti nei processi decisionali che hanno come obiettivo quello di raccomanda- re/rimborsare le tecnologie sanitarie;
• per le problematiche connesse alla associazione a MCDA di approcci quantitativi (ad esempio, peso da attribuire ai criteri di valutazione);
• per la dipendenza dei risultati sulla valutazione dal panel di esperti coinvolti nel processo di valutazione.
Considerando quanto sopra speci cato, potrebbe essere utile:
• strutturare un framework di valutazione nazionale delle nuove offer- te vaccinali (incluse le estensioni di copertura) basato su quanto speci ca- to nel modello proposto da Gonzalez-Lorenzo (Gonzalez-Lorenzo et al2015), che ri ette di fatto i principali domini dell’HTA resi operativi da alcuni elementi speci ci di analisi (questions/criteria). Tali domini fanno riferimento (tabella 1):
- all’impatto della malattia;
- alle caratteristiche del vaccino;
- ai valori ed alle preferenze dei pazienti;
- all’uso delle risorse;
- all’equità;
- alla fattibilità;
• approfondire ulteriormente alcuni requisiti minimi per le evidenze a supporto delle analisi di tipo economico, in considerazione anche dell’esito finale della Task Force dell’ISPOR “Economic Evaluation of Vaccines Designed to Prevent Infectious Disease: Good Practices Task Force”: ad esempio, adozione della prospettiva sociale nelle valutazioni di costo-ef – cacia, ma con l’evidenziazione, come “Caso di riferimento secondario”, dell’analisi nella prospettiva del sistema sanitario; valutazione degli effetti economici dei vaccini utilizzando metodi integrativi alla costo-ef cacia, sopra richiamati;
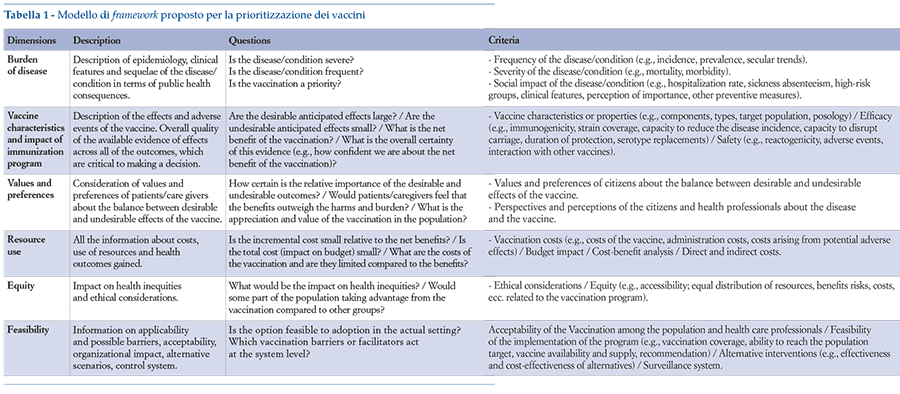
• prevedere, mediante ricorso a panel di esperti, una de nizione delranking di priorità dei singoli domini o, comunque, una valutazione qualitativa di quali dovrebbero essere gli elementi più rilevanti da considerare (imprescindibili rispetto all’adozione dell’offerta vaccinale), finalizzato a supportare i decision-maker (adotto o non adotto un vaccino e con quali modalità).
Con riferimento alla governance complessiva del sistema di prioritiz- zazione, pur non volendo entrare nel merito speci co di tale tema, sareb- be opportuno che:
• le decisioni sulle priorità venissero adottate a livello centrale, con la partecipazione al processo valutativo/decisionale di rappresentanti delle Regioni;
• le evidenze, indipendentemente dal fatto che siano prodotte/raccol- te/sintetizzate dall’industria o da soggetti terzi per conto dell’industria, prevedessero una qualche revisione da parte di un gruppo di ricerca esperto e che non abbia con itti di interesse speci ci sulla valutazione oggetto di revisione critica;
• i rapporti di sintesi di valutazione siano pubblici ai ni di una mag- giore trasparenza del sistema.
3.3. Ulteriori elementi: accordi di rimborso condizionato e nuovo Codice Appalti
La prioritizzazione dipende non solo dai bene ci attesi, ma anche dal loro livello di incertezza e dalle condizioni contrattuali di accesso che ne determinano l’effettivo impatto economico.
In campo farmaceutico (e, in parte, delle altre tecnologie sanitarie) vi sono un interesse ed uso crescenti di accordi di rimborso (e prezzo) con- dizionati alla risposta dei pazienti (accordi outcome-based) ed agli effetti sulla spesa (accordi nancial-based) (MEA, Managed Entry Agreement).
La letteratura sui MEA è molto ampia (si veda la bibliogra a di rife- rimento) e non è questa la sede per una disamina della stessa. Un recente studio (Carlson et al, 2017) presenta una revisione su tutti gli accordi “pubblici” stipulati tra il 1993 ed il 2016, ma nessun accordo sui vaccini viene citato. Solo uno studio in letteratura presentato ad ISPOR e pubblicato come abstract (Terlinden et al, 2014) ha affrontato in termini teorici le potenziali applicazioni dei MEA ai vaccini.
Il PNPV prevede, come opzione applicabile ai vaccini, accordi di tipo nanziario nella direzione di una diminuzione del costo unitario del vaccino in proporzione al raggiungimento di tassi di copertura progressivamente più elevati, secondo modalità che debbano essere concordate tra livello centrale di governo, Regioni ed imprese (costi di acquisto, possibile logistica e meccanismi attuativi).
Con riferimento al tema degli acquisti il Nuovo Codice degli Appalti (D.lgs. n. 50/2016) prevede:
• che l’offerta economicamente vantaggiosa sia il criterio di elezione per l’aggiudicazione delle gare (“fatte salve le disposizioni legislative, re- golamentari o amministrative relative al prezzo di determinate forniture o alla remunerazione di servizi speci ci, le stazioni appaltanti, nel rispetto dei principi di trasparenza, di non discriminazione e di parità di trattamento, procedono all’aggiudicazione degli appalti e all’affidamento dei concorsi di progettazione e dei concorsi di idee, sulla base del criterio dell’offerta economicamente più vantaggiosa individuata sulla base del miglior rapporto qualità/prezzo o sulla base dell’elemento prezzo o del costo, seguendo un criterio di comparazione costo/efficacia…”);
• che possa essere utilizzato il criterio del minor prezzo … per i ser- vizi e le forniture con caratteristiche standardizzate o le cui condizioni sono de nite dal mercato;
• che (considerando quanto previsto dal D.lgs. 50/2017), con rife- rimento agli elementi qualitativi dell’offerta, vengano individuati crite- ri tali da garantire un confronto concorrenziale effettivo sui profili tec- nici e che il punteggio economico non possa superare il 30% (attribuendo quindi alla qualità un peso minimo del 70%).
Nell’area dei farmaci è stato costituito un gruppo di lavoro SIFO- FARE per la declinazione dei criteri con cui de nire la componente “qualità” dei farmaci (data l’assoluta prevalenza dell’aggiudicazione al prezzo più basso), che riguarda non solo le caratteristiche dei farmaci ed il pro lo di tossicità, ma anche aspetti logistici e di servizi di assistenza.
È quindi interessante indagare quale impatto il nuovo Codice degli Appalti avrà nella gestione delle eventuali gare su vaccini e quanto l’erogazione di servizi (oltre ovviamente alle garanzie di requisiti di qualità di prodotto e continuità dell’offerta) possa rappresentare un elemento di valutazione.
3.4. La valutazione da parte delle Regioni
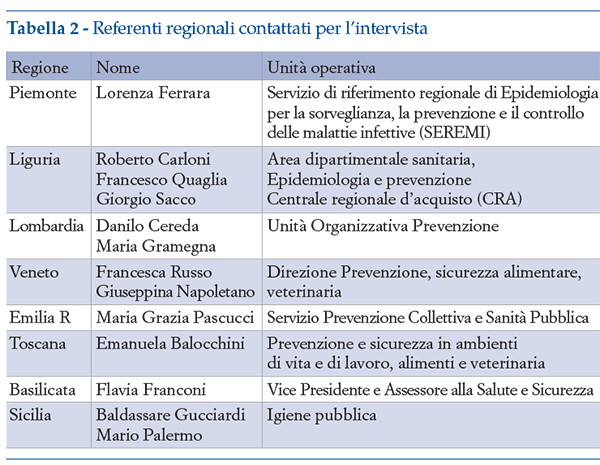
I referenti della prevenzione vaccinale di 8 regioni (Piemonte, Li- guria, Lombardia, Veneto, Emilia-Romagna, Toscana, Basilicata e Sici- lia) (tabella 2) sono stati invitati a rispondere ad un’intervista aperta nalizzata a:
• individuare i criteri e processi decisionali regionali sull’offerta vacci- nale adottati prima del nuovo PNPV;
• raccogliere un’opinione sull’opportunità di de nire un frameworkstrutturato di valutazione dei nuovi vaccini a livello nazionale;
• valutare la percezione circa l’opportunità / praticabilità di MEA in campo vaccinale;
• analizzare le conseguenze attese del nuovo Codice degli Appalti e gli spazi per un inserimento nelle gare della componente di qualità, inclusi eventuali servizi forniti dalle imprese.
Ai referenti contattati è stato esplicitato che l’intervista sarebbe stata regi- strata ed il testo della registrazione sarebbe stato sottoposto a veri ca da parte dei rispondenti. Nello speci co, le domande rivolte alle singole Regioni sono state le seguenti:
1. Nella sua Regione esiste un processo (soggetti coinvolti, tempistica, criteri) di valutazione delle nuove offerte vaccinali o di prioritizzazione (se- lezione, compartecipazioni alla spesa, …) di quelle previste nel calendario nazionale? Se sì, ce lo può descrivere o fornirci la relativa documentazione?
2. Condivide l’idea di de nire un framework più strutturato di valutazione delle nuove offerte vaccinali a livello centrale? Quali sono i vantaggi ed i ri- schi? Come potrebbe contribuire la sua Regione? Sarebbe in grado di fornire un ranking ai domini del framework suggerito da Gonzalez-Lorenzo (Gonza- lez-Lorenzo et al, 2015) o questo dipende dal tipo di vaccino/patologia?
3. Ritiene utile la proposta contenuta nel PNPV 2017-19 di prevedere un abbattimento dei costi unitari dei vaccini in relazione al raggiungimento di determinati livelli di copertura? Se sì, quali problematiche operative intravede?
4. Ci saranno conseguenze sugli acquisti dei vaccini dalla approvazione del nuovo Codice degli Appalti, con riferimento in particolare all’uso dell’offerta economicamente più vantaggiosa come fattore primario nei criteri di aggiudicazione. Quali sono gli aspetti più rilevanti in cui si declina la “qualità” dell’offerta vaccinale? Ritiene che l’offerta di servizi dalle imprese (ad esempio cofinanziamento della campagna di comunicazione) possa rappresentare un fattore quali cante la qualità dell’offerta vaccinale?
Le Regioni che hanno risposto all’invito sono state Piemonte, Liguria, Lombardia e Veneto. Le Regioni per le quali si è chiusa l’intervista sono Pie- monte, Lombardia, Veneto. Regione Liguria ha dato una risposta preliminare per iscritto sulle tematiche dei MEA e del nuovo Codice degli Appalti, che sostanzialmente coincide con la visione delle altre tre Regioni (cfr. infra).
Con riferimento alla prima domanda (criteri e processi di de nizione delle priorità vaccinali) Regione Piemonte ha speci cato come:
• gli organi tecnici regionali principali in materia siano:
- il Gruppo Tecnico regionale per le Vaccinazioni (GTV), che de nisce le priorità regionali in ambito vaccinale e, nello specifico, ha il compito di (i) fornire proposte di modi che o integrazioni delle strategie vaccinali na-zionali e di periodico aggiornamento del PPPV (Piano Piemontese di Prevenzione Vaccinale); (ii) predisporre documenti attuativi tecnico-scientifici quali indicatori per la valutazione, schede vaccinazione, offerta vaccinale ai gruppi a rischio, ecc; (iii) formulare indicazioni e raccomanda- zioni in risposta a speci ci quesiti e richieste, comprese le proposte tecni- che per la predisposizione dei capitolati di gara per l’acquisto dei vaccini;
- il Coordinamento regionale dei RAV (Referenti per le Attività Vaccina- li), istituito nel 2013 con il PPPV 2013-2015, con l’obiettivo di (i) armo- nizzazione su scala regionale le attività vaccinali svolte dalle diverse ASL; (ii) esprimere pareri su documenti attuativi quali il documento sulla qua-lità dei servizi vaccinali e gli indirizzi per il funzionamento dei servizi.
• non esista un framework di valutazione strutturato e formalizzato sulla base del quale il GTV ha de nito nel passato le priorità regionali in ambitovaccinale ed il gruppo stesso non è stato più convocato dal 2015;
• in termini prospettici, dato il PNPV e la tendenziale centralizzazione a livello nazionale delle scelte di prioritizzazione, (i) il GTV stia perdendo di si- gni cato e (ii) diventando più rilevanti gli aspetti di implementazione del pia- no de nito a livello nazionale, assumerà più rilievo il Coordinamento dei RAV. Nell’intervista con Regione Lombardia è stato ripercorso il processoche ha portato alla de nizione del framework:
• di valutazione delle nuove offerte vaccinali (non inserite formalmente nei LEA), in coerenza con l’approccio GRADE (Grading of Recommendations Assessment, Development and Evaluation) nella valutazione della qualità delle prove; - • di decisione basate sull’evidenza, basato sull’approccio DECIDE (Deve- loping and Evaluating Communication Strategies to Support Informed Decisions and Practice Based on Evidence) nella formulazione di raccomandazioni.
È stato poi specificato come il modello lombardo preveda tre fasi:
• prioritizzazione da parte della Regione Lombardia di quesiti rilevanti a partire anche da segnalazioni del territorio (aziende sanitarie, società scienti che, ecc.);
• eventuale af damento dell’istruttoria, qualora non esista un dossiercompleto dell’Istituto Superiore Sanità o indicazioni Ministeriali, attraverso bando, ad un soggetto terzo (organo tecnico-scienti co vaccini), avente com- petenze di tipo metodologico, statistico epidemiologico ed economico e che deve garantire indipendenza da possibili con itti di interesse rispetto al vacci- no considerato (tale attività è stata af data con bando all’Università degli Stu- di di Milano per il 2017). Nello speci co, l’istruttoria si riferisce ai sei domini, cui corrispondono i diversi indicatori individuati attraverso una consultazio- ne mediante metodica Delphi (Gonzalez-Lorenzo et al, 2015) (cfr. supra);
• valutazione dell’istruttoria da parte di un panel multidisciplinare, comprendente rappresentanti del mondo dell’Università, delle Società scienti che, delle Associazione dei Pazienti, della Sanità Pubblica e degli enti del Servizi Sanitario Regionale. Il panel è stato costituito a marzo 2016 come Commissione Vaccini. Il panel, attraverso un processo di condivisio- ne coordinato dall’organo tecnico-scienti co vaccini, ha il compito di esprimere le raccomandazioni utilizzando il metodo DECIDE (parere fa- vorevole, sfavorevole o condizionale alla nuova strategia).
• L’obiettivo originario del framework lombardo era fornire una valutazione strutturata a supporto delle decisioni di eventuale allargamento dell’offerta vac- cinale rispetto a quanto previsto nel Piano Nazionale Vaccini 2012-2014, anche a fronte di decisioni di allargamento adottate da altre Regioni. Il framework è stato testato con riferimento alla varicella, mentre non è stato utilizzato per scelte più recenti a livello regionale (offerta meningoccoco B in copagamento).
La Regione Lombardia ha osservato come:
• nella sostanza l’approvazione del PNPV riduca in modo sostanziale l’ambito di applicazione del framework come strumento di decisione di al- largamento dell’offerta vaccinale a livello regionale, in quanto:
l’inclusione dei nuovi vaccini previsti dal PNPV nei LEA rende ne- cessario per le Regioni erogare la nuova offerta vaccinale;
l’offerta vaccinale è molto ampia e nel breve/medio periodo non ci sono le condizioni per un’ulteriore allargamento di tale offerta;
• sia previsto che il framework, per quanto applicabile ed utile, venga utilizzato a supporto della gestione delle gare (de nizione dei capitolati), con la nalità di aumentare l’efficienza nell’offerta;
• un altro potenziale utilizzo del framework sia rappresentato dalle scelte di prioritizzazione su popolazione a rischio, mentre non si prevede il suo utilizzo per le valutazioni di impatto organizzativo, almeno a breve termina.
Ai ni della de nizione del Calendario Vaccinale Regionale (2005, 2008; 2014 – ultimo aggiornamento pre PNPV avvenuto con DGR 1564/2014) (tabella 3), la Regione Veneto si è basata su un approccio e percorso decisionale strutturato, che risponde alla volontà di prioritizzare l’offerta sulla base della necessità, ad individuare i vaccini da offrire e a valutare l’impatto economico ed organizzativo (risorse necessarie, comu- nicazione alla popolazione, formazione degli operatori sanitari).
Nel processo decisionale sono coinvolti:
• all’interno della Regione la Direzione Prevenzione, Sicurezza Alimen- tare, Veterinaria, l’U.O. Prevenzione e Sanità Pubblica, l’Area Sanità e So- ciale, il Centro di riferimento per le malattie batteriche invasive, la Commis- sione Regionale Vaccini., costituita con DGR 985/20144;
• il Comitato tecnico scienti co in materia di “Sospensione dell’obbli- go vaccinale”5, costituito con DGR 569/2011, la cui composizione è stata modi cata con DGR 985/2014, facendola coincidere con la Commissione Regionale Vaccini, con la presenza del Ministero della Salute e dell’Istituto Superiore di Sanità;
• i Dipartimenti di Prevenzione nonché le Unità Territoriali / Distretti delle Aziende ULSS coinvolti nei gruppi di lavoro di cui infra e nella Commissione Regionale Vaccini di cui supra;
• l’Università degli Studi di Padova (Scuola di Medicina e Chirurgia), che svolge, tra gli altri aspetti, un’azione di sorveglianza dei ceppi preva- lenti, nalizzata ad istruire le scelte regionali.

Ai fini delle scelte, sono stati costituiti gruppi di lavoro, nalizzati, con riferimento agli aspetti di prioritizzazione, alla disamina delle evidenze di- sponibili a sostegno dell’estensione e dell’introduzione dei vaccini del calen- dario. I gruppi di lavoro si sono occupati anche di valutare la dotazione or- ganica dedicata alle attività dei servizi vaccinali oltre che valutare ed individuare le modalità comunicative e di offerta rivolte alla popolazionetarget per favorire la compliance e di stendere un piano formativo per tutti gli operatori coinvolti. L’attività dei gruppi di lavoro è stata approvata dalla Commissione Regionale Vaccini.
Le valutazioni effettuate includono diversi domini tipici di un HTA, richiamati, anche se in modo non organico, dalla DGR 1564/2014 (Allega- to B), includendo come sopra speci cato la valutazione di fattibilità / im- patto organizzativo.
La Regione Veneto, peraltro, nel settembre 2015, ha partecipato, insie- me alla Regione Lombardia e all’Università di Milano, ai lavori per la stesura del framework sulla valutazione dei nuovi vaccini (cfr. supra). Il modello tuttavia, pur essendo stato condiviso, non è stato applicato a livello regiona- le essendo stato da poco (un anno) approvato il nuovo calendario vaccinale che aveva introdotto nuovi vaccini compreso quello per la varicella.
L’interesse per la valutazione di impatto economico- nanziario ed or- ganizzativo è ulteriormente dimostrato dal fatto che la DGR 1564/2014 ha previsto in modo esplicito (i) che le sedi vaccinali debbano essere in nume- ro adeguato a garantire un corretto rapporto tra la super cie territoriale servita e il numero di residenti, assicurando la presenza di personale dedi- cato necessario a garantire l’attività di pro lassi delle malattie infettive; (ii) uno stanziamento ad hoc per l’implementazione del nuovo calendario vac- cinale da destinare in via prioritaria al personale.
Tra le evidenze a supporto delle decisioni della Regione Veneto, oltre a quelle scienti che di letteratura, vengono utilizzati i dati epidemiologici re- gionali (ad esempio, sistema di sorveglianza delle meningiti), i dati prove- nienti dalle Schede di Dimissione Ospedaliere (SDO) (ad esempio, analisi dei dati SDO su casi di polmonite – polmonite come prima diagnosi di di- missione; meningite, setticemia o empiema in prima diagnosi di dimissione associata a polmonite in uno degli altri 5 campi; analisi dei ricoveri per pato- logie HPV-correlate), studi di valutazione di impatto economico (ad esem- pio, valutazione del costo associato ai ricoveri per condilomatosi).
Tutte e tre le Regioni hanno convenuto che avere un framework strut- turato di prioritizzazione a livello nazionale sia importante e sia rilevante chiarire quale sia il potenziale ruolo in tale senso del neonato Gruppo Tecnico Consultivo Nazionale sulle Vaccinazioni (NITAG) (cfr. supra).
Tuttavia, le regioni intervistate hanno considerato come più rilevante un supporto sulla sostenibilità dell’allargamento dell’offerta vaccinale (an- che se Regione Veneto è stata in gran parte anticipatoria di tale estensione e si è già posta il problema dell’impatto organizzativo ed economico- finanziario) in un momento storico complesso e caratterizzato dal problema della riduzione della copertura vaccinale e dall’implementazione dell’obbligo vaccinale per la frequentazione scolastica.
È stato anche segnalato come le valutazioni sui nuovi vaccini a livello nazionale dovrebbero essere rapide, basate sui dati epidemiologici, ef ca- cia ed ef cienza dei vaccini stessi e si debba tenere in giusta considerazio- ne la dimensione della fattibilità organizzativa (anche per questo il coin- volgimento delle Regioni è molto rilevante).
È stata anche osservata la necessità di una coerenza tra valutazione per l’aggiornamento dell’offerta vaccinale e politiche di prezzo in sede AIFA, nel caso di classi cazione in fasce di rimborsabilità (A/H) con conseguente negoziazione del prezzo (ad esempio, non si rintraccia tale coerenza nei prezzi negoziati per i vaccini anti-in uenzali).
La proposta del PNPV 2017-19 di prevedere un abbattimento dei co sti unitari dei vaccini in relazione al raggiungimento di determinati livelli di copertura vaccinale è stata giudicata interessante da tutte e tre le Regioni, ma è stato sottolineato come:
• sia molto difficile da attuare;
• l’accordo dovrebbe essere gestito centralmente, anche se gli acquisti sono gestiti poi a livello regionale e si dovrebbero evitare problematiche di gestione avute sull’area farmaci (ad esempio, accordi prezzo/volume per i farmaci per l’epatite C);
• sia necessario comprendere quale possa essere l’effetto rispetto a dinamiche di gara a livello regionale (o interregionale come è avvenuto in Lombardia e Veneto), volte ad aumentare il potere contrattuale (aumento dei volumi richiesti) o a generare meccanismi competitivi tra diverse imprese.
La visione su accordi outcome-based è più critica, in quanto giudicata difficilmente applicabile ai vaccini, in relazione:
• all’efficacia tendenzialmente elevata, con un livello di incertezza sull’esito più basso rispetto ai farmaci;
• alla dipendenza degli effetti dal grado di copertura vaccinale;
• alla dif coltà di individuare delle misure di esito;
• alla possibile sottostima degli eventi (es. noti che episodi influenzali).
Con riferimento agli acquisti, la valutazione generale delle due Regioni è che:
• il nuovo Codice degli Appalti non modificherà in modo sostanziale le modalità di acquisto dei vaccini;
• laddove possibile, verrà applicato il criterio di aggiudicazione per beni ad alta standardizzazione (prezzo);
• l’applicazione del criterio prezzo-qualità, con l’attribuzione alla qualità del 70% minimo del peso, avrà problematiche (anche per beni di- versi dai vaccini), con alto rischio di ricorsi di partecipanti ai bandi;
• l’erogazione di servizi parte delle imprese difficilmente verrà presa in considerazione come criterio determinante dell’aggiudicazione della gara, in quanto vi è una chiara preferenza di gestione in economia della campagna vaccinale (Regione Piemonte ha specificato di non avere accettato la proposta di un’impresa di fornire come servizio una campagna di recall).
In particolare, Regione Piemonte (con Valle d’Aosta), per tramite SCR (Società di Committenza Piemonte) e con il supporto del Settore Assistenza Farmaceutica Integrativa e Protesica, rispetto alle gare ha adottato ed adotterà il seguente approccio:
• se esistono indirizzi nazionali vincolanti sulla copertura con vaccini a maggiore copertura di ceppi, tali indirizzi verranno seguiti;
• se non ci sono tali indirizzi e non vi sono differenze signi cative sul pro lo di impatto sul target più rilevante, si utilizzeranno gare a prezzo;
• se tali differenze esistono (ad esempio vaccino influenza) verranno effettuate gare a lotti separati.
3.4. Quali le possibili ri essioni conclusive?
Considerando le evidenze emerse dalla letteratura e le indicazioni regionali è possibile delineare alcune possibili conclusioni in forma di raccomandazione per la futura gestione dell’ingresso di nuovi vaccini.
Superate le fasi più critiche di implementazione del nuovo PNPV, è importante strutturare un framework di valutazione nazionale delle nuove offerte vaccinali ed il modello proposto da Gonzalez-Lorenzo (Gonzalez-Lorenzo et al, 2015), che riflette di fatto i principali domini dell’HTA resi operativi da alcuni elementi speci ci di analisi, potrebbe essere un riferimento a livello nazionale. È comunque necessario nell’ambito del framework (cfr. supra):
• strutturare le evidenze di costo-efficacia (e di impatto sulla spesa)
in modo che le problematiche di applicazione di tale analisi ai vaccini vengano da subito affrontate;
• prevedere, mediante ricorso a panel di esperti, una de nizione delranking di priorità dei singoli domini o, comunque, una valutazione quali- tativa di quali dovrebbero essere gli elementi più rilevanti da considerare (imprescindibili rispetto all’adozione dell’offerta vaccinale), valutazione nalizzata a supportare i decision-maker (adotto/non adotto/adotto in modo condizionato un vaccino e con quali modalità);
• prevedere una governance complessiva del sistema di prioritizzazione, secondo quanto già speci cato (centralizzazione e supporto di soggetti terzi nella valutazione).
Il sistema non sembra ancora abbastanza maturo per una diffusione di MEA. Qualora dei modelli di abbattimento dei costi per livello di raggiungimento della copertura vaccinale venissero implementati è importante che: 1) tali accordi siano pienamente trasparenti, per evitare comporta- menti regionali opportunistici di “attesa” nella vaccinazione per poter sfruttare gli sconti ottenuti ed in modo che le Regioni possano fare una ragionevole piani cazione nanziaria; 2) sia previsto un sistema di veri ca sistematica del raggiungimento del livello di copertura vaccinale.
Non si prevedono (e si ritengono utili in questa fase complessa) accordi MEA outcome-based, in quanto deve essere considerata prioritaria la de nizione di un framework di riferimento per la valutazione delle nuove offerte vaccinali. Per gli acquisti, sarebbe importante che, nonostante dub- bi e perplessità delle Regioni, (i) i servizi nanziati dalle imprese possano rappresentare uno dei criteri di aggiudicazione, anche se non con peso rilevante; (ii) si faccia ogni sforzo per applicare, laddove possibile, il criterio dell’offerta economicamente vantaggiosa, anche se questo è reso critico dal peso del 70% attribuito alla qualità.
3.5. Riferimenti bibliografici
Revisione non sistematica sulla letteratura relativa alla prioritizzazione dei vaccini
- Ahmed F, et al. ACIP Evidence Based Recommendations Work Group (EBRWG). Methods for developing evidence-based recommendations by the Advisory Committee on Immunization Practices (ACIP) of the U.S. Centers for Disease Control and Prevention (CDC). Vaccine 2011; 29:9171-6.
- AndreaeMC,etal.BasisforimmunizationrecommendationsamongcountriesoftheWorld Health Organization European region. Hum Vaccin 2009; 5: 754-60.
- AkazawaM,etal.Consideringeconomicanalysesintherevisionofthepreventivevaccinationlaw: a new direction for health policy-making in Japan? Health Policy Amst Neth 2014; 118: 127-34.Barnighausen T, et al. Rethinking the bene ts and costs of childhood vaccination: The example of the Haemophilus in uenza type b vaccine. Vaccine 2011; 29: 2371-80.Beutels P, et al. Methodological issues and new developments in the economic evaluation of vaccines. Exp Rev Vaccines 2003; 2: 649-60.BlackS.The role of health economic analyses in vaccine decision making.Vaccine2013;31:6046-9.Blau J, et al. Indicators to assess National Immunization Technical Advisory Groups(NITAGs). Vaccine 2013; 31: 2653-7.Blecher MS, Meheus F, et al. Financing vaccinations – the South African experience.Vaccine 2012; 30 Suppl 3: C79-86.Bryson M, et al. A systematic review of national immunization policy making processes.Vaccine 2010; 28 Suppl 1: A6-12.Burchett HED, et al. National decision-making on adopting new vaccines: a systematicreview. Health Policy Plan 2012; 27 Suppl 2: ii62-76.Curto A, et al. Vaccination planning and vaccine prices in a decentralizing country – Italy.Exp Rev Pharmacoecon Outcomes Res 2014; 14: 195-202.Duclos P, et al. Developing evidence-based immunization recommendations and GRADE.Vaccine 2012; 31: 12-9.Erickson LJ, et al. An analytical framework for immunization programs in Canada.Vaccine 2005; 23: 2470-6.Gasparini R, et al. Health Technology Assessment e vaccinazioni in Italia. Global & RegionalHealth Technology Assessment 2014; 1: 16-24.Gilca V, et al. Setting priorities for new vaccination programs by using public health of cersand immunization managers opinions. Vaccine 2008; 26: 4204-9.González-Lorenzo M, et al. Conceptual frameworks and key dimensions to supportcoverage decisions for vaccines. Vaccine 2015; 33: 1206-17.Grabenstein JD, Nevin RL. Mass immunization programs: principles and standards.Curr Top Microbiol Immunol 2006; 304: 31-51.Houweling H, National Immunisation Programme Review Committee of the Health Councilof the Netherlands. Criteria for inclusion of vaccinations in public programmes.Vaccine 2010; 28: 2924-31.Joint Committee on Vaccination and Immunisation (JCVI). Code of Practice June 2013.London: Joint Committee on Vaccination and Immunisation (JCVI), National Health Service, 2013. Available at: https://www.gov.uk/government/uploads/system/uploads/attachment_data/ le/224864/JCVI_Code_of_Practice_revision_2013_-_ nal.pdf.IsmailSJ,etal.Canada’sNationalAdvisoryCommitteeonImmunization(NACI):evidence-based decision-making on vaccines and immunization. Vaccine 2010; 28 Suppl 1: A58-63.Madhavan G, et al. Bridging the gap: need for a data repository to support vaccine prioritization efforts. Vaccine 2015; 33 Suppl 2: B34-9.Ranking Vaccines: A Prioritization Framework – Phase I: Demonstration of Concept and
a Software Blueprint. Available at: http://www.nationalacademies.org/hmd/Reports/2012/ Ranking-Vaccines-A-Prioritization-Framework-Phase-I.aspx. Washington, DC:
Institute of Medicine, National Academies Press; 2012Marsh K, et al. Estimating cost-effectiveness in public health: a summary of modelling and valuation methods. Health Econ Rev 2012; 2: 17.McDaid D, Needle J. Economic evaluation and public health: Mapping the literature. Cardiff, UK: Health Promotion Division, Welsh Assembly Government; 2006.Nohynek H, et al. VENICE National Gatekeepers. National Advisory Groups and their role in immunization policy-making processes in European countries. Clin Microbiol Infect Off Publ Eur Soc Clin Microbiol Infect Dis 2013; 19: 1096-105.Opel DJ, et al. A critique of criteria for evaluating vaccines for inclusion in mandatory school immunization programs. Pediatrics 2008; 122: e504-10.PhelpsCE,MadhavanG.Strategicprioritysettingforvaccinespolicyandglobalhealth education. Lancet Glob Health 2015; 3: S17.BPisoCW.Decisionsupportinvaccinationpolicies.Vaccine2009;27:5923-8.
- Revicki DA, Lenderking WR. Methods and issues associated with the use of quality-adjusted life-years. Exp Rev Pharmacoecon Outcomes Res 2012; 12: 105-14.
- Smith JC, et al. Advisory Committee on Immunization Practices. Immunization policy development in the United States: the role of the Advisory Committee on Immunization Practices. Ann Intern Med 2009; 150: 45-9.
- Takla A, et al. Characteristics and practices of National Immunisation Technical Advisory Groups in Europe and potential for collaboration, April 2014. Euro Surveill Bull Eur Sur Mal Transm Eur Commun Dis Bull 2015; 20(9).
- Verguet S, et al. Universal public nance of tuberculosis treatment in India: An extended cost-effectiveness analysis. Health Economics 2015; 24: 318-32.
- Verguet S, et al. Health gains and nancial risk protection afforded by public nancing of selected interventions in Ethiopia: an extended cost-effectiveness analysis. Lancet Global Health 2015; 3: e288-96.
- Wailoo A, et al. The incorporation of health bene ts in cost utility analysis using the EQ-5D: Report by the Decision Support Unit. Shef eld, UK: School of Health and Related Research, University of Shef eld, 2010.
- WHO | Principles and considerations for adding a vaccine to a national immunization programme. WHO. Managed Entry Agreements• Adamski J, et al. Risk sharing arrangements for pharmaceuticals: potential considerations and recommendations for European payers. BMC Health Serv Res 2010; 10: 153.
- Baron-Papillon F, et al. Managed-Entry Agreements: Possible Options for Vaccines in Europe? (http://www.ispor.org/Scienti cPresentationsDatabase/Presentation/52578).
- Carlson JJ, et al. Performance-Based Risk-Sharing Arrangements: An Updated International Review. Pharmacoeconomics 2017; 35: 1063-72.
- Carlson et al. Current status and trends in performance-based risk-sharing arrangements between healthcare payers and medical product manufacturers. Appl Health Econ Health Policy 2014; 12: 231-8.
- Carlson JJ, et al. Linking payment to health outcomes: A taxonomy and examination of performance-based reimbursement schemes between healthcare payers and manufacturers.Health Policy 2010; 96: 179-90.
- Garrison Jr. et al. Performance-based risk-sharing arrangements – Good practices for design, implementation, and evaluation: Report of the ISPOR good practices for performance-based risk-sharing arrangements task force. Value Health 2013; 16: 703-19.
- Jommi C (2018). Managed Entry Agreements and High Cost Medicines (European Perspective), in Zaheer-Ud-Din Babar (ed.). Equitable Access to High-Cost Pharmaceuticals, Springer, London, 2018.
- Terlinden A, et al. Potential risk-sharing agreements for vaccines. Value Health 2014; 17: 7 (A669-A670).MCDA• Marsh K, et al. Multiple Criteria Decision Analysis for Health Care Decision Making– Emerging Good Practices: Report 2 of the ISPOR MCDA Emerging Good Practices Task Force. Value Health 2016; 19: 125-37.
- Thokala P, et al. Multiple Criteria Decision Analysis for Health Care Decision Making–An Introduction: Report 1 of the ISPOR MCDA Emerging Good Practices Task Force. Value Health 2016; 19: 1-13.
- Timmis JK, et al. Improving accountability in vaccine decision-making. Exp Rev Vaccines 2017; 16: 1057-1066.Altro• Ben Hadj Yahia MB, et al. Extending the Human Papillomavirus Vaccination Programme to Include Males in High-Income Countries: A Systematic Review of the Cost-Effectiveness Studies. Clin Drug Investig 2015; 35: 471-85.
- • Haeussler,K,etal.Cost-EffectivenessAnalysisofUniversalHumanPapillomavirusVaccination Using a Dynamic Bayesian Methodology: The BEST II Study. Value in Health 2015; 18: 956-68.
1. https://www.htai.org/ leadmin/HTAi_Files/ISG/Vaccines/HTAi_Vaccines_IG_ToR_ nal_231116.pdf (data ultimo accesso: 31 Ottobre 2017).
2.https://www.ispor.org/TaskForces/Economic_Analysis_of_Vaccines_to_Prevent_ Infectious_Disease_DRAFT-9-19-17.pdf (data ultimo accesso: 31 Ottobre 2017).
3. http://www.ijph.it/hta.php (ultimo accesso, 30 Ottobre 2017).
4. La Commissione Regionale Vaccini è un organo di consulenza per l’aggiornamento del calendario vaccinale e con il compito di esaminare i problemi legati ai tassi di copertura derivanti dall’adesione all’offerta vaccinale, nonché di valutare l’andamento epidemiologico delle malattie prevenibili con vaccinazione. La Commissione è composta da 14 membri, referenti della Regione, delle Aziende ULSS, dell’Azienda Ospedaliera Universitaria Integrata di Verona, dell’Università degli Studi di Padova, di FIMMG e dei Pediatri di Libera Scelta.
5. Si ricorda che dal 2008 è stato sospeso nella Regione Veneto l’obbligo vaccinale, con un contemporaneo monitoraggio semestrale dei tassi di copertura vaccinale regionale e l’attivazione di diversi strumenti a supporto di tale scelta e, in generale, delle politiche vaccinali regionali: Anagrafe vaccinale unica regionale; Attivazione di un Canale Verde per la sorveglianza delle reazioni avverse a vaccini; Attività sistematica di formazione, a partire dal 2006 ed in FAD – Formazione a Distanza dal 2010, per gli operatori dei servizi vaccinali, pediatri di libera scelta e personale sanitario ospedaliero e territoriale coinvolto nelle attività di prevenzione delle malattie infettive; Materiale informativo sui vaccini rivolto ai genitori; Indagini ad hoc di natura percettiva (“Indagine sui determinanti del ri uto vaccinale nella Regione Veneto”, effettuato nel Periodo: 1 giugno 2009 – 31 maggio 2011).



