Gruppo di Studio Fondazione Smith Kline “Misurare il valore delle nuove terapie attraverso i PROs”
Fondazione Smith Kline, Verona
Tendenze nuove, Numero Speciale 2020; 55-63: DOI: 10.32032/TENDENZENS202007.PDF
 Scarica Pdf
Scarica Pdf
Introduzione
La terapia standard per il trattamento dell’infezione da HIV ad alta efficacia consiste tipicamente in regimi con dosaggio farmacologico quotidiano costituiti dall’associazione di 3 o 4 diversi farmaci che consentono di prevenire la progressione della patologia e la ricorrenza del virus. Mentre i progressi nel trattamento hanno notevolmente migliorato l’aspettativa di vita delle persone affette da HIV, rimangono alcuni importanti bisogni da soddisfare. La maggior parte delle persone che vivono con HIV esprime preoccupazione sugli effetti a lungo termine dell’assunzione dei farmaci antiretrovirali e sul peso complessivo che la terapia continuativa e l’elevato numero di molecole farmacologicamente attive da assumere quotidianamente (da 3 a 4 al giorno come standard) comportano su benessere complessivo e sulla qualità di vita1.
Pertanto la ricerca si sta orientando verso regimi ART efficaci, ma costituiti da un ridotto numero di principi attivi, al fine di contribuire a ridurre il carico farmacologico antiretrovirale quotidiano e cumulativo nel tempo, e le interazioni farmacologiche con i farmaci concomitanti assunti dal paziente. Questi aspetti sono ancora più rilevanti in età avanzata, sia per le molteplici comorbidità croniche che si sviluppano anche per l’infiammazione legata alla infezione cronicizzata, sia per gli indubitabili e talora non ancora pienamente esplorati effetti tossici a lungo termine dei farmaci antiretrovirali. L’impatto della riduzione del numero di dosi giornaliere di singoli farmaci nel corso di una vita di trattamento è intuitivo, anche se clinicamente difficilmente verificabile nel breve termine. È indubbio che i regimi a due farmaci permetteranno di ridurre della metà (vs regimi composti da quattro principi attivi) o di un terzo (vs regimi con tre molecole antiretrovirali) l’esposizione ai farmaci, e che questa riduzione avrà un impatto progressivamente maggiore considerando l’esposizione cumulativa nel tempo e il tipo di molecole risparmiate all’organismo dei soggetti in trattamento2.
Altra linea di ricerca punta inoltre a sviluppare molecole che consentano di ridurre la frequenza di assunzione orale oggi quotidiana, attraverso somministrazioni settimanali orali o mensili-plurimensili iniettive, o addirittura di sospendere temporaneamente la terapia antiretrovirale attraverso l’utilizzo di farmaci immunomodulatori.
È evidente come questo tipo di impostazione di ricerca per il trattamento dell’HIV richieda che l’innovazione sia valutata non solo con i classici outcome viro-immunologici, ma anche necessariamente attraverso outcome in grado di misurare il beneficio complessivo dei nuovi regimi terapeutici per le persone con HIV.
Riduzione del carico farmacologico
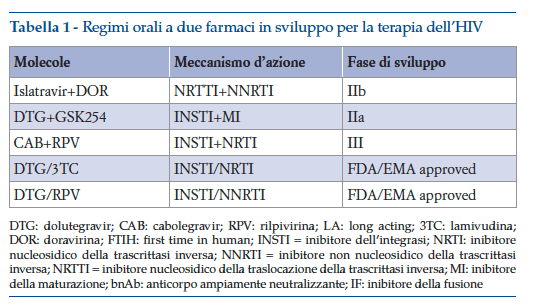
La ricerca di nuovi farmaci antiretrovirali per la terapia dell’infezione da HIV punta oggi a selezionare unicamente molecole, sia con meccanismi di azione consolidati sia nuovi, che abbiano una elevata potenza antivirale e una superiore barriera genetica allo sviluppo di ceppi virali resistenti3. Molecole con queste caratteristiche permettono infatti sia di ridurre le dosi complessive di farmaco, sia di utilizzare una terapia efficace diminuendo il numero di principi attivi del regime terapeutico. Già oggi infatti sono disponibili regimi a due soli farmaci e, osservando il panorama delle nuove molecole in sviluppo, si vede come queste siano sperimentate prevalentemente in regimi a soli due farmaci (tabella 1).
Riduzione della frequenza di somministrazione
Tuttora una ottimale aderenza alla terapia antiretrovirale richiede estremo rigore, attenzione e precisione da parte del paziente e adeguate spiegazioni da parte del medico curante: anche le combinazioni fisse di farmaci devono essere assunte ogni 24 ore e non in qualsiasi momento della giornata, molti farmaci devono essere presi in concomitanza con pasti caloricamente adeguati per assicurare un ottimale assorbimento, e per molte molecole è necessario porre attenzione alle interazioni con altri farmaci che possono determinare una alterazione della concentrazione plasmatica con conseguente riduzione di efficacia o un aumento di tossicità.
La ricerca su nuove terapie antiretrovirali si sta quindi focalizzando sullo sviluppo di molecole chimiche e biologiche a lunga durata d’azione, sia intrinseca che attraverso innovative tecnologie farmaceutiche, tali da permettere di ridurre la frequenza di somministrazione, estremamente importante per un trattamento che necessita massima aderenza per evitare riprese dell’infezione, e che oggi prevede somministrazioni orali quotidiane per tutta la vita (circa 40 anni di trattamento continuativo).
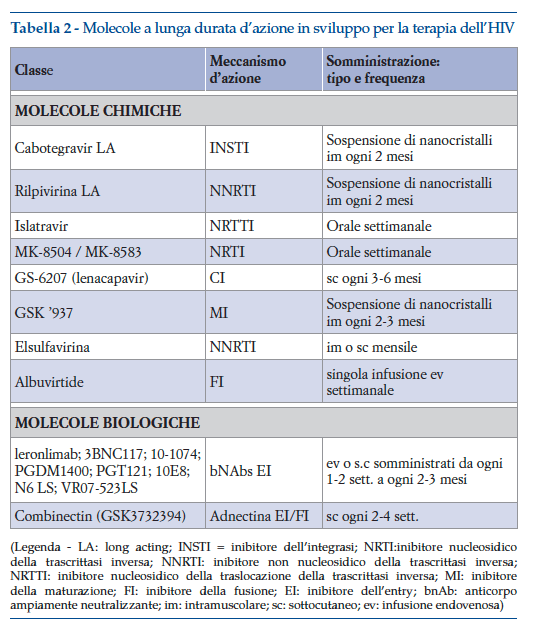
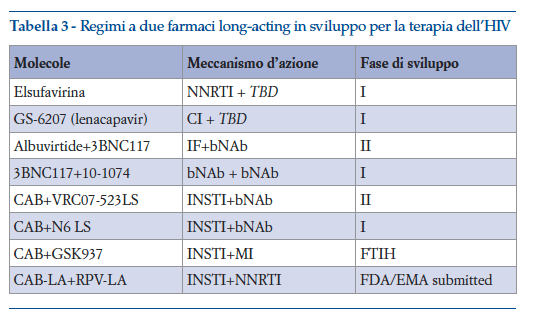
Necessitando però di un trattamento con un regime a più farmaci, è essenziale che le singole molecole del regime possano avere simile durata d’azione, tali da permettere somministrazione meno frequente ma concomitante. Quindi anche in questo caso la ricerca deve necessariamente orientarsi verso lo sviluppo di regimi a soli due farmaci. Una delle maggiori difficoltà è quindi identificare due molecole long acting, tra quelle elencate in tabella 2, che possano essere associate per creare una terapia completa con un numero ridotto di somministrazioni. Alcuni esempi sono già in fase di sviluppo completo e valutazione regolatoria (cabotegravir LA + rilpivirina LA), altri in fase iniziale di sviluppo, mentre per altre molecole long acting lo sviluppo come regime completo è rallentato dalla non ancora avvenuta identificazione del composto da associare (tabella 3).
La combinazione long acting di cabotegravir e rilpivirina, già disponibile per il trattamento anche in Europa entro la fine di quest’anno, prevede la somministrazione intramuscolare ogni due mesi dei due farmaci in formulazione di nanocristalli in sospensione. Questa proposta, pur non essendo identificata dalle autorità regolatorie come «di elevato interesse per la salute pubblica dal punto di vista della innovazione terapeutica» (vedi programma PRIME dell’Agenzia Europea per i medicinali), da alcuni indicatori di indagini direttamente sui pazienti 4,5, si prospetta come rivoluzionaria nel rapporto tra il paziente e la malattia. Infatti, la possibilità di cancellare il ricordo quotidiano dell’infezione (da 365 somministrazioni di terapia/anno a 6), il fatto di essere un potenziale inibitore dello stigma (perché preserva la privacy nella assunzione/somministrazione) e di contribuire al miglioramento dell’aderenza, sono tutti fattori concorrono alla definizione di un tipo di innovatività forse non istituzionalmente riconosciuta, ma molto probabilmente apprezzata dall’utilizzatore finale.
Per quanto riguarda in particolare il ruolo degli anticorpi ampiamente neutralizzanti e a lunga durata d’azione nell’ambito della futura terapia dell’infezione da HIV, sono in sperimentazione due possibili utilizzi: come intensificazione di terapia con un antiretrovirale long-actingin un regime a due componenti terapeutiche, una chimica e la seconda biologica (primo esempio in corso con uno studio ACTG è l’associazione tra cabotegravir LA e VR07-523LS) (NCT03739996 – Clinica Traials.gov), oppure come mantenimento con solo trattamento con bNAb durante periodi di sospensione della terapia antiretrovirale. Un primo studio proof of concepttha dimostrato la validità di questo approccio terapeutico che potrebbe in futuro permettere periodi di “vacanza terapeutica” dagli antiretrovirali attraverso somministrazioni di un singolo bNAb distanziate nel tempo6, o di due bNAbs associati (3BNC117 + 10-1074) per aumentare il controllo virologico e distanziare ulteriormente le somministrazioni fino a una per trimestre, permettendo anche la totale sospensione di qualsiasi terapia per 21 settimane7.
Conclusioni
La ricerca di nuove molecole e di approcci terapeutici per la terapia dell’infezione da HIV si sta orientando verso due bisogni fondamentali ancora da soddisfare rispetto alla epidemiologia e alle caratteristiche della popolazione delle persone sieropositive allo stato attuale e per quanto prevedibile nei prossimi 10 anni:
a) nuove molecole con nuovi meccanismi d’azione ed elevata barriera alla resistenza per i pazienti multitrattati nel tempo e con poche o nulle opzioni terapeutiche ancora disponibili. Questa popolazione comporta un elevato costo sanitario e sociale, ma nei paesi occidentali non supera il 3-5% della popolazione sieropositiva;
b) molecole e regimi che permettano una complessiva riduzione del cosiddetto medication burden, e abbiano quindi un impatto complessivo sul benessere del paziente. Questo rappresenta il bisogno per la stragrande maggioranza della popolazione sieropositiva (più del 90%), prevede molecole e regimi che comportino riduzione del carico farmacologico e della frequenza di somministrazione, ed è ancora più rilevante considerando che la popolazione con HIV sta rapidamente invecchiando. Le proiezioni indicano infatti che le persone con HIV di età uguale o superiore ai 50 anni passeranno dal 28% del 2010 al 73% nel 2030; di queste l’84% avrà almeno una malattia concomitante, e un terzo almeno tre; la stima è inoltre che almeno il 40% avrà complicazioni legate all’uso dei regimi antiretrovirali oggi considerati di prima linea dalle linee guida internazionali 8,9.
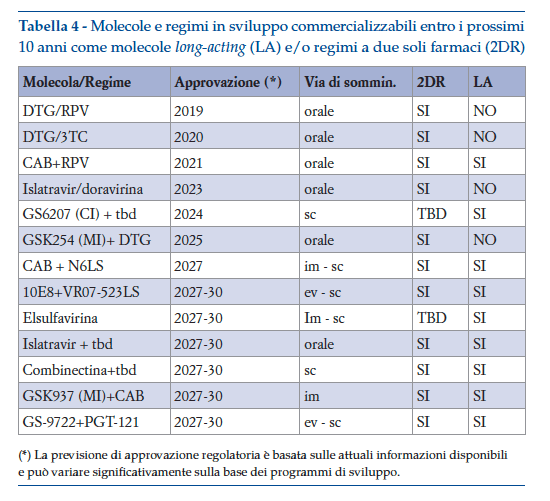
Appare evidente come, per la prima popolazione, la valutazione dei nuovi farmaci potrà ancora avvalersi dei classici endpoint viro-immunologici, mentre per la popolazione al punto b), per la quale entro i prossimi 10 anni la ricerca farmacologica permetterà una vera rivoluzione nel modo di trattare l’infezione (tabella 4), si rende necessaria una valutazione dei nuovi approcci terapeutici anche attraverso outcome adeguati a differenziare le diverse terapie sulla base dell’impatto complessivo sul benessere del paziente.
Bibliografia
1. Marcotullio S, et al. EU Patient Experience & Views on Antiretroviral Treatment – Findings from the Positive Perspectives Study. EACS 2017. Poster PE25/9.
2. Cattaneo D, Rizzardini G. L’evoluzione della terapia ARV nel paziente HIV: l’opzione delle 2DR nella gestione del medication burden. It J Public Health 2020; vol. 9, n. 3, in press.
3. Llibre JM, Pulido F, Garcia F, et al. Genetic barrier to resistance for dolutegravir. AIDS reviews 2015; 17: 56-64.
4. Matza LS, Paulus TM, Garris CP, et al. Qualitative Thematic Analysis of Social Media Data to Assess Perceptions of Route of Administration for Antiretroviral Treatment among People Living with HIV. Patient 2020; doi: 10.1007/s40271-020-00417-8.
5. Rusconi S, Marcotullio S, Cingolani A. Long-acting agents for HIV infection: biological aspects, role in treatment and prevention, and patient’s perspective. New Microbiol 2017; 40: 75-9.
6. Wang CY, et al. Effect of Anti-CD4 Antibody UB-421 on HIV-1 Rebound After Treatment Interruption. N Engl J Med 2019; 380:1535-45.
7. Mendoza P, Gruell H, Nogueira L, et al. Combination therapy with anti-HIV-1 Abs maintains viral suppression. Nature 2018; 561: 479-84.
8. Smit M, Brinkman K, Geerlings S, et al. Future challenges for clinical care of an ageing population infected with HIV: a modelling study. Lancet Infect Dis 2015; 15: 810-8.
9. Smith JM, Flexner C. The challenge of polypharmacy in an aging population and implications for future antiretroviral therapy development. AIDS 2017; 31 Suppl 2: S173-S184.
Gruppo di Studio Fondazione Smith Kline
“Misurare il valore delle nuove terapie attraverso i PROs”
• Massimo Andreoni, Università Tor Vergata, Roma;
• Andrea Antinori, IRCCS Spallanzani, Roma;
• Giovanni Apolone, Fondazione IRCCS Istituto Nazionale Tumori, Milano;
• Elio Borgonovi, CERGAS, SDA Bocconi e Fondazione Smith Kline;
• Cinzia Brunelli, Fondazione IRCCS Istituto Nazionale Tumori, Milano;
• Oriana Ciani, CERGAS, SDA Bocconi;
• Antonella Cingolani, Università Cattolica del Sacro Cuore, Policlinico “A. Gemelli”, Roma;
• Lucio Da Ros, Fondazione Smith Kline;
• Claudio Jommi, CERGAS, SDA Bocconi;
• Simone Marcotullio, Consulente Socio Sanitario;
• Paolo Rizzini, Fondazione Smith Kline;
• Stefano Vella, Università Cattolica del Sacro Cuore, Roma.



