Elisabetta Ravot1, Roberto Ascione1
1Healthware Group, Salerno, Milano
Tendenze nuove, Numero Speciale n.01 2021; 101-110: DOI: 10.32032/TENDENZENS20210107.PDF
 Scarica Pdf
Scarica Pdf
La proposizione di un modello italiano di business e accesso per le terapie digitali (DTx) può trarre vantaggio dagli esempi già disponibili in altri Paesi. Al momento della redazione di questo documento (ultimo aggiornamento: settembre 2020) la gran parte delle soluzioni di Digital Health, con particolare riferimento alle DTx, non beneficia di alcun tipo di rimborsabilità. Questa situazione, ampiamente estesa a livello mondiale, è tuttavia in una fase di rapida evoluzione, guidata principalmente da recenti e sostanziali aggiornamenti in alcuni Paesi. Di particolare interesse, sulla scena europea, la recente approvazione in Germania del “Digital Healthcare Act” (DVG, Digitale-Versorgung-Gesetz), che introduce la possibilità di un percorso rapido per l’accesso al mercato delle DTx. Obiettivo di questo articolo è presentare una sintetica rassegna degli elementi più rappresentativi nello scenario internazionale, con un focus su alcuni Paesi chiave.
Negli Stati Uniti d’America (USA), la mancanza di un sistema sanitario esteso pone l’onere del pagamento delle soluzioni sanitarie digitali direttamente a carico degli utenti/pazienti. Questa situazione genera uno scenario diversificato, in cui convivono esempi di soluzioni di Digital Health o DTx direttamente pagate dagli utenti, accanto a un numero crescente di casi nei quali i costi sono coperti da player diversi. Esistono soluzioni di Digital Health che hanno acquisito grande popolarità, ad esempio OneDrop (gestione del diabete), Headspace e Calm (salute mentale/meditazione), in grado di iscrivere milioni di utenti paganti, solitamente in forma di abbonamenti mensili versati direttamente agli sviluppatori. Inoltre, le assicurazioni sanitarie private e alcune aziende ospedaliere stanno iniziando a sviluppare o a concedere in licenza le proprie soluzioni di Digital Health, con l’obiettivo di ridurre il profilo di rischio degli iscritti (nel caso delle assicurazioni), o di rispondere più adeguatamente agli specifici bisogni di salute della popolazione nelle aree in cui operano, così come di favorire il raggiungimento degli obiettivi federali relativi alla riduzione delle riammissioni ospedaliere (nel caso delle aziende ospedaliere). Un’altra forma emergente di rimborso negli Stati Uniti è l’inclusione delle soluzioni sanitarie digitali nei formulari di grandi aziende, le quali sovvenzionano il costo dei trattamenti offrendoli ai propri dipendenti come forma di welfare aziendale.
L’inclusione di approcci e strumenti di salute digitale è un importante obiettivo nella pianificazione a medio termine negli USA, come evidenziato dal fatto che l’Office of the National Coordination for Health Information Technology statunitense ha incluso le DTx nel piano federale 2020-2025 (Federal Health IT Strategic Plan). Tra le strategie individuate, il piano punta a sviluppare l’uso di DTx basate sull’evidenza come opzioni terapeutiche per la prevenzione, la gestione e il trattamento attraverso l’uso di smartphone, tablet e altri device personali.
Nel Regno Unito (UK), il National Health System (NHS) già da tempo ha sviluppato un ampio catalogo di soluzioni digitali dedicate alla salute e al benessere, certificate ed accessibili attraverso la NHS App Library, a sua volta inclusa nella NHS App. In alcuni casi, il NHS ha negoziato accordi di licenza con sviluppatori di App di Digital Health, con l’obiettivo di rendere tali soluzioni gratuitamente disponibili a tutti i suoi assistiti. Le App incluse in questa selezione sono prevalentemente finalizzate a supportare l’utente/paziente nell’assumere un ruolo più attivo nella gestione della propria salute mentale e fisica. Per essere inclusi in questo catalogo, i prodotti devono dimostrare la propria conformità agli standard definiti da NHS Digital, compresa la necessità di fornire evidenze riguardo il raggiungimento degli outcome clinici o riferiti dal paziente, la sicurezza clinica, la stabilità tecnica, oltre a informazioni sulla protezione dei dati, l’usabilità e l’accettabilità, e l’interoperabilità. Per un approfondimento sui criteri di valutazione da parte del NHS delle App e degli strumenti digitali dedicati alla salute, è possibile consultare:
https://digital.nhs.uk/services/nhs-apps-library/guidance-for-health-app-developers-commissioners-and-assessors/how-we-assess-health-apps-and-digital-tools (ultimo accesso 30 settembre 2020).
Il percorso delineato dal NHS è ampio, diversificato e in evoluzione, ed è ben rappresentato nella “NHS Roadmap for patient digital services”. Tale mappa, periodicamente aggiornata, fornisce informazioni sullo status (disponibile, di recente introduzione, in lavorazione, previsto) delle risorse digitali sviluppate da NHS per i pazienti. La mappa completa, attualmente giunta alla sua quinta versione, è disponibile su:
https://eu-rm.roadmunk.com/publish/0dbd8ebaa98e26573e09b1d1fc74433d486ee5d2/ (ultimo accesso 30 settembre 2020).
È, inoltre, interessante notare che il NHS ha contestualmente istituito una NHS Digital Academy, iniziativa nata dalla collaborazione tra NHS, Imperial College di Londra, Università di Edimburgo e Harvard Medical School, per favorire la formazione e lo sviluppo di una nuova generazione di leader digitali, in grado di guidare la trasformazione del NHS.
In Francia, un esempio significativo di rimborso per una piattaforma di Digital Health è quello di Diabeo(Voluntis), un dispositivo medico digitale per il dosaggio dell’insulina. La HAS (Haute Autorité de Santé) ha approvato il rimborso di Diabeo limitatamente ai casi in cui questa soluzione sia prescritta nell’ambito di un consulto di telemedicina; tale decisione è legata al fatto che la Francia nel 2019 aveva già autorizzato il teleconsulto da parte dei medici, attraverso piattaforme di telemedicina approvate, riconoscendo ai medici un compenso per tale attività.
È evidente come il caso di Diabeo in Francia possa creare un precedente che può facilitare e velocizzare un simile iter approvativo per il rimborso di ulteriori soluzioni di Digital Health, incluse le DTx. Ed è legittimo ipotizzare che la dinamica di accesso alla rimborsabilità in un quadro di teleconsulto abbia un’influenza sullo sviluppo di ulteriori soluzioni da parte di provider che intendano accedere al mercato francese (ovvero, indirizzare lo sviluppo di Digital Health o DTx in modo che siano prescrivibili e utilizzabili in un contesto di teleconsulto).
In Francia, degno di menzione anche un ulteriore esempio: l’HAS ha incluso, nella sua lista di prodotti e servizi sanitari rimborsabili da parte della sanità pubblica, Moovcare Poumon, un dispositivo medico basato su software utile a rilevare, attraverso telemonitoraggio, le recidive e le complicazioni durante il follow-up di pazienti affetti da neoplasia polmonare ad alto rischio di recidiva. Il documento originale contenente il parere positivo da parte di HAS può essere consultato ai seguenti link:
https://www.has-sante.fr/jcms/c_2964253/fr/moovcare-poumon
(ultimo accesso 30 settembre 2020).
In Belgio, su iniziativa del governo federale e in collaborazione con molteplici soggetti interessati, è disponibile mHealthBelgium, la piattaforma per applicazioni mobili che hanno marchio CE come dispositivo medico. Questa piattaforma centralizza tutte le informazioni rilevanti, necessarie e convalidate, delle applicazioni destinate a pazienti, professionisti sanitari e istituzioni sanitarie.
La piattaforma (consultabile in 3 lingue: olandese, francese, inglese) consente di ottenere informazioni su marchio CE, GDPR, conformità, rispetto delle regole di sicurezza e di autenticazione, costo e finanziamento della App di interesse.
Le App incluse nella piattaforma sono classificate sulla base di una piramide di validazione a 3 livelli:
• M1: rappresenta il livello di base ed include criteri quali la certificazione CE come medical device e la compliance GDPR;
• M2: si fonda su criteri di interoperabilità e connettività alla piattaforma eHealth;
• M3: è riservato alle App che possono dimostrare un valore aggiunto in termini socio-economici ed eleggibili a rimborso.
La gestione complessiva di mHealthBelgium è operata da beMedTech (federazione di settore dell’industria delle tecnologie mediche) e Agoria (associazione che rappresenta le imprese attive nel settore tecnologico), in stretta collaborazione con 3 autorità nazionali:
• Agenzia federale per la medicina e i prodotti sanitari (FAMHP): l’autorità competente responsabile della sicurezza, della qualità e dell’efficacia di farmaci e prodotti sanitari, responsabile del livello M1;
• Piattaforma eHealth: organizzazione federale eHealth che costruisce l’infrastruttura per lo scambio di informazioni in ambito sanitario, responsabile per il livello M2;
• NIHDI: Istituto nazionale per l’assicurazione sanitaria e l’invalidità, responsabile del rimborso di prodotti e servizi sanitari, responsabile del livello M3.
Per approfondimenti è possibile consultare: https://mhealthbelgium.be (ultimo accesso 30 settembre 2020).
La novità più rilevante in Europa riguarda l’ormai nota approvazione da parte del Parlamento tedesco delle nuove regole a sostegno dell’innovazione digitale in Germania. Il nuovo percorso ha avuto inizio nel dicembre 2019, quando il Legislatore ha delineato il DVG (Digitale-Versorgung-Gesetz), uno specifico regime normativo per le applicazioni di salute digitale (DiGA, Digitale Gesundheitsanwendungen). Per consentire l’implementazione del DVG, il Ministero Federale della Salute ha emesso l’ordinanza DiGaV (disponibile al link https://hih-2025.de/wp-content/uploads/2020/04/DiGAV_RefE.pdf; ultimo accesso 30 settembre 2020), entrata in vigore il 21 Aprile 2020. Il 27 maggio 2020 il BfArM (Bundesinstitut fuer Arzneimittel und Medizinprodukte) ha iniziato a ricevere le prime applicazioni; l’avvio del registro con l’inclusione dei primi DiGA è previsto per il mese di ottobre 2020 (figura 1). È stato recentemente comunicato che il DVG sarà iterativo: coerentemente con i processi di sviluppo agile, la normativa seguirà un percorso di apprendimento ed adattamento nel tempo.
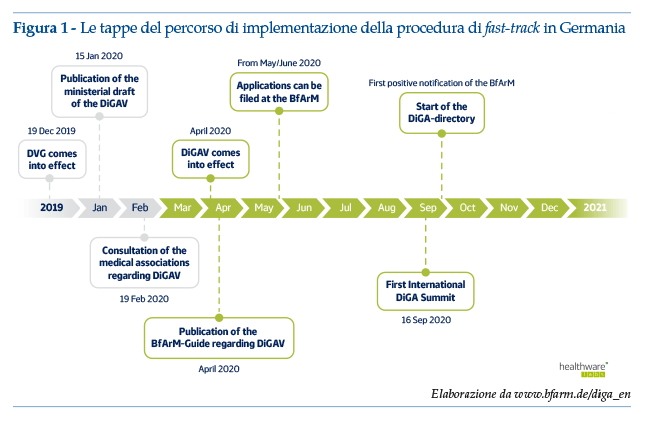
La nuova normativa tedesca, che ha un potenziale impatto sui 73 milioni di cittadini coperti dal servizio sanitario nazionale e sui loro medici curanti, nel suo insieme cerca di armonizzare le esigenze degli sviluppatori (rapida immissione sul mercato e minimizzazione dei rischi di obsolescenza) e la regolamentazione sui dispositivi medici, che richiede la validazione scientifica prima della commercializzazione.
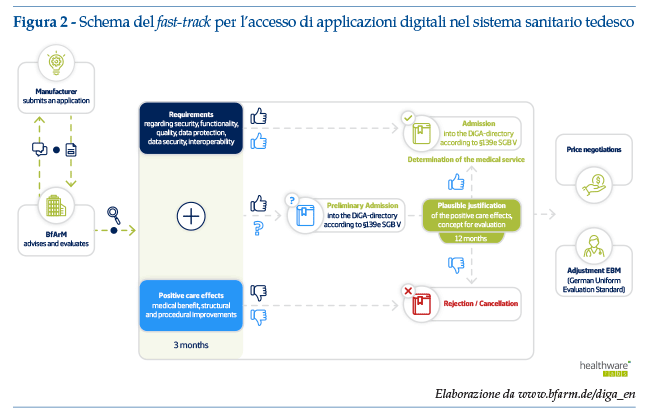
Il cuore della normativa consiste nella creazione di un percorso di approvazione rapida (fast-track, figura 2) delle soluzioni di salute digitale.
Il 16 settembre 2020 si è svolto il primo Summit Internazionale DiGA, che ha visto più di 1.500 partecipanti da oltre 40 Paesi, in cui è stato presentato lo stato dell’arte della normativa, con interventi di BfArM e del Ministero Federale della Salute; i dettagli dell’evento sono disponibili su: https://hih-2025.de/en/international-diga-summit-summary-video-docs-next-steps/ (ultima consultazione 30 settembre 2020).
In sintesi, i punti chiave nell’attuale scenario tedesco sono i seguenti:
• I DiGA sono definiti come device medicali, certificati CE e classificati a basso rischio (classi I e IIa), la cui funzione principale sia basata su tecnologie digitali e che abbiano uno scopo medicale, ovvero siano a supporto dell’identificazione, monitoraggio, trattamento o sollievo di una patologia o disabilità, e che siano utilizzati dal paziente (in autonomia o insieme all’operatore sanitario).
• Il DiGA può essere prescritto e rimborsato solo dopo aver completato con successo la valutazione da parte del BfArM ed essere stato incluso nel registro dei DiGA.
• Il DiGA dovrà aver dimostrato uno o più effetti positivi sulla salute. Tali effetti possono consistere in un beneficio di natura medica, oppure in un miglioramento rilevante per il paziente in termini di struttura e processi della cura. Quest’ultima categoria include, ad esempio, l’aderenza terapeutica, l’autonomia del paziente, la “health literacy” del paziente, la facilitazione dell’accesso alle cure, ulteriori esiti relativi al miglioramento della vita quotidiana del paziente.
• Gli studi per la produzione delle evidenze di beneficio devono essere condotti in Germania. In casi specifici possono essere accettati studi condotti interamente o in parte in altri Paesi, a condizione che la situazione sanitaria e la popolazione studiata siano corrispondenti allo scenario della Germania.
• Il fornitore può richiedere una registrazione definitiva o provvisoria. In caso di registrazione provvisoria, viene previsto un periodo di prova sino a 12 mesi; da notare che il fornitore può accedere una sola volta alla registrazione provvisoria. Se viene richiesta la registrazione definitiva e l’applicazione viene rifiutata, il fornitore non potrà più accedere ad una registrazione provvisoria, bensì dovrà attendere un anno prima di presentare una ulteriore applicazione (evidentemente producendo ulteriori dati ed evidenze rispetto alla prima applicazione). Ne consegue che il fornitore deve soppesare attentamente le due opzioni di applicazione, sulla base delle evidenze già disponibili e di quelle in corso di dimostrazione. Il BfArM offre consulenza informale in merito.
• I fornitori di DiGA avranno la possibilità di dimostrare l’efficacia delle loro soluzioni sul mercato entro un anno e di negoziare i prezzi con l’organizzazione ombrello delle assicurazioni sanitarie pubbliche tedesche (GKV-SV, Gesetzlichen Krankenversicherung Spitzenverband).
• I medici sono autorizzati a prescrivere le App medicali che hanno superato i test di sicurezza dei dati e di funzionalità e sono state incluse nel registro BfArM (figura 3).
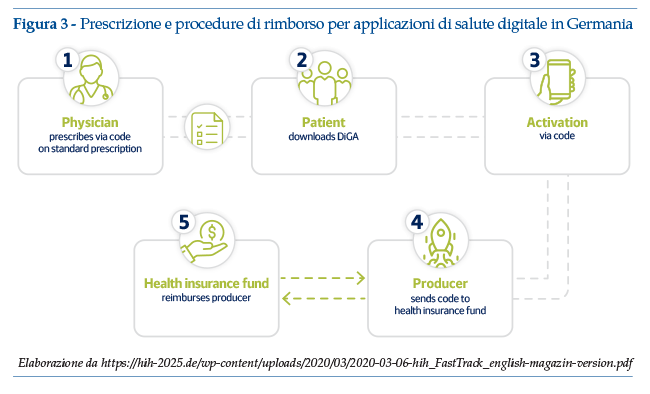
A partire dal maggio 2020, ovvero meno di un anno dopo la redazione del primo draft della DVG, i fornitori di App mediche possono presentare istanza di fast-track all’agenzia regolatoria tedesca BfArM, fornendo una documentazione che supporti l’approccio scientifico alla soluzione sviluppata e le informazioni tecniche sulla sicurezza dei dati e sui test di funzionalità/risultati dell’App. BfArM ha redatto uno specifico documento di linee guida al fast-track, destinato a produttori, fornitori di servizi e utenti. Le linee guida rappresentano probabilmente il documento più completo e accessibile per la comprensione della normativa e delle sue applicazioni; alla fine di agosto 2020 è stata pubblicata anche una versione in lingua inglese delle linee guida, disponibile su: https://www.bfarm.de/SharedDocs/Downloads/EN/MedicalDevices/DiGA_Guide.pdf?__blob=publicationFile&v=2 (ultimo accesso 30 settembre 2020).
Il 16 settembre 2020 si è svolto il primo Summit Internazionale DiGA, che ha visto più di 1.500 partecipanti da oltre 40 Paesi, in cui è stato presentato lo stato dell’arte della normativa, con interventi di BfArM e del Ministero Federale della Salute; i dettagli dell’evento sono disponibili su: https://hih-2025.de/en/international-diga-summit-summary-video-docs-next-steps/ (ultima consultazione 30 settembre 2020).
In sintesi, i punti chiave nell’attuale scenario tedesco sono i seguenti:
• I DiGA sono definiti come device medicali, certificati CE e classificati a basso rischio (classi I e IIa), la cui funzione principale sia basata su tecnologie digitali e che abbiano uno scopo medicale, ovvero siano a supporto dell’identificazione, monitoraggio, trattamento o sollievo di una patologia o disabilità, e che siano utilizzati dal paziente (in autonomia o insieme all’operatore sanitario).
• Il DiGA può essere prescritto e rimborsato solo dopo aver completato con successo la valutazione da parte del BfArM ed essere stato incluso nel registro dei DiGA.
• Il DiGA dovrà aver dimostrato uno o più effetti positivi sulla salute. Tali effetti possono consistere in un beneficio di natura medica, oppure in un miglioramento rilevante per il paziente in termini di struttura e processi della cura. Quest’ultima categoria include, ad esempio, l’aderenza terapeutica, l’autonomia del paziente, la “health literacy” del paziente, la facilitazione dell’accesso alle cure, ulteriori esiti relativi al miglioramento della vita quotidiana del paziente.
• Gli studi per la produzione delle evidenze di beneficio devono essere condotti in Germania. In casi specifici possono essere accettati studi condotti interamente o in parte in altri Paesi, a condizione che la situazione sanitaria e la popolazione studiata siano corrispondenti allo scenario della Germania.
• Il fornitore può richiedere una registrazione definitiva o provvisoria. In caso di registrazione provvisoria, viene previsto un periodo di prova sino a 12 mesi; da notare che il fornitore può accedere una sola volta alla registrazione provvisoria. Se viene richiesta la registrazione definitiva e l’applicazione viene rifiutata, il fornitore non potrà più accedere ad una registrazione provvisoria, bensì dovrà attendere un anno prima di presentare una ulteriore applicazione (evidentemente producendo ulteriori dati ed evidenze rispetto alla prima applicazione). Ne consegue che il fornitore deve soppesare attentamente le due opzioni di applicazione, sulla base delle evidenze già disponibili e di quelle in corso di dimostrazione. Il BfArM offre consulenza informale in merito.
• I fornitori di DiGA avranno la possibilità di dimostrare l’efficacia delle loro soluzioni sul mercato entro un anno e di negoziare i prezzi con l’organizzazione ombrello delle assicurazioni sanitarie pubbliche tedesche (GKV-SV, Gesetzlichen Krankenversicherung Spitzenverband).
• I medici sono autorizzati a prescrivere le App medicali che hanno superato i test di sicurezza dei dati e di funzionalità e sono state incluse nel registro BfArM (figura 3).
• I consulti telematici diventano la norma. I professionisti sanitari possono promuovere attivamente i loro servizi di teleassistenza ai pazienti, ad esempio sui loro siti web. I prezzi dei servizi di teleassistenza sono ancora negoziati, ma dovrebbero essere presto chiariti.
• Le assicurazioni sanitarie pubbliche tedesche dovranno inviare in forma anonima i dati demografici e sanitari dei membri a una banca dati centrale gestita dal governo tedesco. Le organizzazioni di ricerca e le Università possono richiedere l’accesso ai dati per scopi di ricerca. Ciò garantirà un migliore accesso ai dati dei pazienti per la ricerca.
• Ogni assicurato avrà accesso a una cartella clinica elettronica. Entro gennaio 2021 ogni assicurato di un’assicurazione sanitaria pubblica (73 milioni di persone) dovrà avere accesso a una cartella clinica elettronica.
• La comunicazione medico – paziente e le prescrizioni, in una prima fase su supporto cartaceo, saranno progressivamente migrate su canali elettronici. Le prescrizioni elettroniche di medicinali, rimedi e mezzi ausiliari, le indicazioni scritte del medico e i certificati d’invalidità per i datori di lavoro saranno consentiti. La tradizionale comunicazione via fax non sarà incoraggiata.
• Le farmacie, i professionisti sanitari e gli ospedali sono tenuti a collegarsi a reti di comunicazione sicure. Tutte le farmacie, gli ospedali e i professionisti sanitari devono collegarsi alla rete tedesca di dati sanitari sicuri, messa a disposizione da Gematik. In caso di inosservanza, sono previste sanzioni pecuniarie.
• Le assicurazioni sanitarie offriranno l’iscrizione online ai membri.
• L’innovazione sanitaria sarà sostenuta finanziariamente. Il governo tedesco ha prolungato di 4 anni il finanziamento di 200 milioni di euro all’anno per sostenere progetti di innovazione nel settore sanitario.
Overview: casi esemplificativi di rimborso
per Digital Health o DTx
A livello globale, esistono diversi prodotti di Digital Health o DTx che stanno attualmente beneficiando di copertura da parte di payer locali, regionali o nazionali. Di seguito una rassegna di news relative a casi rappresentativi (dettagli disponibili su: https://dtxalliance.org/dtxcoverage/ (ultima consultazione 30 settembre 2020).
• Express Scripts’ Digital Health Formulary: A Foundation for the Future of Pharmacy(12 dicembre 2019)
• Blue Cross and Blue Shield of Minnesota Launches Omada’s Type 2 Diabetes Management Program(13 novembre 2019)
• Big Health’s Sleepio product receives coverage by the NHS (20 maggio 2019)
• WellDoc’s BlueStar product receives coverage by Business Health Care Group(14 maggio 2019)
• Omada Health’s product receives coverage by Priority Health (3 ottobre 2018)
• Palo Alto Health Sciences’s Freespira product receives coverage by Highmark Inc.(24 settembre 2018)
• Omada Health’s product receives coverage by Cigna(18 settembre 2018)
• Propeller Health’s product receives coverage by Anthem Blue Cross and Blue Shield(16 agosto 2018)
• Voluntis’ Insulia product receives coverage by WellDyneRx (14 maggio 2018)
• Propeller Health’s product receives coverage by Express Scripts (16 novembre 2017).
Un esempio significativo di accessibilità, e che riguarda entrambi i mercati UK e USA, è quello di Sleepio, una DTx personalizzata per la gestione dei disturbi del sonno, basata su tecniche di terapia cognitivo-comportamentale (CBT), clinicamente validata (33 pubblicazioni scientifiche peer-reviewed, inclusi 8 studi clinici randomizzati). Sulla base delle evidenze cliniche ottenute, l’American College of Physicians ha riconosciuto Sleepio come CBT di prima linea nel trattamento dell’insonnia cronica. Grazie ad una partnership con il NHS, attualmente Sleepio è liberamente accessibile in UK in diverse regioni (tra cui 8 milioni di utenti nell’area metropolitana di Londra e 2.3 milioni nella Thames Valley). Negli USA Sleepio è stata inclusa nel formulario di CVS Health (azienda di gestione dei benefit sanitari) e oltre 2 milioni di utenti risultano coperti privatamente tramite aziende che comprendono questa App nei piani di benefit per i propri dipendenti; attualmente, quindi, più di 12 milioni di persone possono avere un accesso gratuito a Sleepio.
Conclusioni
L’industria delle DTx è in fase iniziale di sviluppo e, mentre grande attenzione viene legittimamente data alla creazione di percorsi di regolamentazione e sviluppo clinico, è anche opportuno considerare che la generazione di flussi significativi di revenue è, e sarà, una delle principali sfide di questo settore in tutti i mercati.
La strada verso un modello funzionante di accesso è stata aperta anche in Europa; la normativa tedesca, da poco entrata in vigore, rappresenta un decisivo passo in avanti, nonché un forte acceleratore, e offre un modello al quale altri Paesi europei possono ispirarsi.
Anche in Italia è necessario valutare e definire sin da subito quali modelli di accesso e rimborsabilità possono essere praticabili e sostenibili; il caso della Germania può costituire una base di partenza significativa per una proposizione italiana mirata.
What is known
• Gli elementi noti consistono nell’esperienza attualmente disponibile e nelle fonti istituzionali e normative citate nel presente articolo.
What is uncertain
• Al momento attuale (fast-track in Germania da poco operativo), sarà interessante comprendere come i fornitori risponderanno, quante application verranno effettuate, se prevarranno le application in modalità definitiva o provvisoria, quale sarà il rate di approvazione/rifiuto, in che tempi sarà effettivamente data risposta, etc. In definitiva, è incerta (nel senso che è stata di recente avviata, dunque da verificare) l’efficacia della messa in pratica della DVG. I primi inserimenti di DiGA sono previsti per ottobre 2020; è plausibile che a fine 2020/inizio 2021 saranno resi noti i primi dati relativi al processo.
• In Italia non è chiaro se il ruolo attualmente svolto in Germania da BfArM possa/debba essere svolto da AIFA o dal Ministero della salute.
What we recommend
• Raccomandiamo di considerare il modello tedesco come base per una proposizione italiana mirata.



