Oriana Ciani1 e Lucio Da Ros 2
1CERGAS, SDA Bocconi, Milano; 2Fondazione Smith Kline, Verona
Tendenze nuove, Numero Speciale 3 2021; 5-26: DOI: 10.32032/TENDENZENUOVENS03202101.PDF

Introduzione
L’esperienza rivela come dimostrare l’efficacia di un’innovazione non sia di per sésufficiente a garantirne l’automatica assimilazione nella pratica clinica. Un filone di ricerca relativamente nuovo, la scienza dell’implementazione (Implementation Science, IS), si è sviluppato per studiare come migliorare e facilitare l’adozione di innovazioni, interventi e procedure di comprovata efficacia in modo da aumentare il loro impatto sulla salute pubblica.
La scienza dell’implementazione ha l’ambizione di seguire un metodo scientifico, e condivide pertanto molte caratteristiche e l’approccio rigoroso della ricerca clinica. Tuttavia, si distingue per finalità, metodi e ambiti di applicazione occupandosi di fattori che includono l’identificazione e la risoluzione degli ostacoli e dei facilitatori nell’adozione di innovazioni cliniche basate sull’evidenza.
In questo documento presentiamo brevemente la definizione, la storia e l’ambito dell’implementation science, in relazione al più noto e ampio settore della ricerca clinica.
Perché c’è bisogno di IS: alcuni esempi
Dati di letteratura indicano come spesso siano necessari quasi 17 anni per assorbire alcune innovazioni nella pratica clinica1. Inoltre, meno della metà di queste vengono a fare parte delle attivitàdi routine all’interno dei sistemi sanitari2. Alcuni autori hanno concluso che, a causa di questo divario, la gran parte degli investimenti in ricerca biomedica ha un impatto minimo sulla salute pubblica3.
In questo contesto, una innovazione nell’erogazione e nell’organizzazione dei servizi sanitari è intesa come un insieme di comportamenti, routine e modalità, insieme a qualsiasi tecnologia e sistema amministrativo associato, che sono:
• percepiti come nuovi da una parte dei portatori di interessi chiave;
• collegati alla fornitura o al sostegno dell’assistenza sanitaria;
• in discontinuità con la pratica precedente;
• tesi a migliorare i risultati di salute, l’efficienza amministrativa, il rapporto costo-efficacia o l’esperienza dell’utente;
• attuati mediante azioni pianificate e coordinate da individui, team o organizzazioni.
Tali innovazioni possono o meno essere associate a una nuova tecnologia sanitaria4.
Questo ritardo potrebbe essere attribuito al passo rapido della ricerca scientifica che, secondo alcuni, ha superato la capacitàdi assorbimento di innovazione (absorptive capacity) delle organizzazioni sanitarie o della società, in generale. In realtà, questo fenomeno è vecchio di secoli.
La letteratura di riferimento per IS riporta spesso di un caso esemplare di innovazione (i.e. creazione di team semi-indipendenti per promuovere la corretta implementazione di linee guida cliniche), che funzionava perfettamente nell’ala ovest di un reparto ma stentava a decollare nell’ala est dello stesso reparto, a un solo corridoio di distanza. Questo caso è noto come “Six West problem”5. Ancora, Bauer et al. descrivono un nuovo modello di cura per disturbo bipolare (Collaborative Chronic Care Model – CCM) che in oltre tre anni di follow-up in uno studio randomizzato aveva mostrato un impatto positivo significativo su una batteria di outcomes rilevanti. Tuttavia, a oltre un anno di distanza dalla pubblicazione dei risultati, nessuno dei 15 centri giàcoinvolti nello studio aveva inserito questa nuova modalitàdi cura tra le proprie routines6. Ulteriori esempi del ritardo tra la produzione di prove di efficacia e la diffusione di nuovi interventi si trovano nel lento assorbimento del vaccino contro il vaiolo, della penicillina o dell’insulina. Più recentemente, Bluestar, la prima app a ricevere l’approvazione della Food and Drug Administration (FDA) americana come terapia di prescrizione mobile per l’autogestione del diabete sulla base di studi preliminari, non ha mostrato successivamente alcun effetto sul controllo glicemico, evidenziando l’importanza di fattori contestuali, come la preparazione del centro e l’addestramento degli utenti, nel determinare l’efficacia della app7. In ambito infettivologico, un recente lavoro ha studiato con un framework di diffusione dell’innovazione il caso delle nuove terapie per epatite C, evidenziando diversi fattori contestuali, come la cultura organizzativa o l’approccio a silos, il ruolo dei medici di base o l’elusione di alcuni passaggi nelle linee guida, quali ostacolanti o abilitanti della diffusione dei nuovi antivirali ad azione diretta8. Questi esempi contrastano con la rapida diffusione dei trattamenti antiretrovirali per l’HIV/AIDS, dove fattori contestuali, oltre all’efficacia del trattamento, hanno giocato un ruolo cruciale nella velocitàdi adozione su larga scala di un’innovazione9.
Questi e altri esempi di mancata adozione di innovazioni a livello ospedaliero o di cure primarie conferma che, oltre alla forza delle evidenze, è fondamentale riflettere sul contesto in cui queste dovrebbero essere assimilate, incluse le discipline professionali dei potenziali destinatari10.
La definizione di IS
Uno dei padri fondatori dell’IS è Rogers, che nella pubblicazione “Diffusion of innovations” (1962)11 concettualizzò la diffusione dell’innovazione come processo sociale con molteplici determinanti, ben oltre le prove a sostegno dell’innovazione stessa. Altri autori hanno sottolineato altri aspetti contestuali, come l’utilizzo della conoscenza (knowledge utilization), o il trasferimento tecnologico (technology transfer), che non procede liberamente e autonomamente nemmeno all’interno delle singole organizzazioni12.
La definizione più comune di IS è:
“…lo studio scientifico dei metodi per promuovere la diffusione sistematica dei risultati della ricerca o altre innovazioni di comprovata efficacia nella routine clinica, con lo scopo di migliorare la qualitàed efficacia dei servizi sanitari”13.
Quindi l’obiettivo di IS non è quello di stabilire se un’innovazione clinica ha un impatto sulla salute oppure no, ma piuttosto di identificare e promuovere quei fattori che ne influenzano l’inserimento in routine organizzative.
In altre parole, IS si focalizza su:
• Identificare le barriere e i facilitatori dell’innovazione su più livelli (soggetti in trattamento, providers, organizzazione, altri gruppi di stakeholder);
• Sviluppare e applicare strategie di implementazione che superino le barriere e promuovano i facilitato, per sostenere l’adozione di innovazioni basate sulle evidenze.
Data questa definizione, IS è parente stretta di una serie di discipline che vanno dal management alla scienza delle organizzazioni, fino allo studio del comportamento individuale e dell’unitàsociale, soprattutto in risposta a un cambiamento. La scienza dell’implementazione è contigua ad altri campi come quello del miglioramento della qualità, che di solito però inizia con un problema specifico piuttosto che con una nuova pratica da diffondere. Un altro campo attiguo è quello della tradizionale disseminazione dei risultati della ricerca, che di solito però si concentra sulle strategie di comunicazione, educazione e veicolazione di informazioni10.
Ricerca clinica per la IS
Da alcuni anni sta emergendo la necessitàdi spostare gli studi clinici dall’ambiente rarefatto del centro medico accademico, a quello più tipico di utilizzo dell’innovazione da testare. In altre parole, il focus della ricerca clinica si è ampliato per includere, nello stesso studio o in studi diversi, non solo la validità interna della valutazione (che dà priorità a isolare gli effetti del trattamento da ogni influenza esterna al fine di determinare se questo ha effettivamente un impatto), ma anche considerazioni di validità esterna (che dà priorità alla pertinenza e trasferibilitàdegli effetti del trattamento in situazioni in cui l’innovazione dovràfunzionare tipicamente). Questa tendenza ha portato al moltiplicarsi di studi clinici ispirati al concetto generale di “effectiveness studies”, “practice-based research”, “pragmatic clinical trials”14.
Tuttavia, gli esempi illustrati in precedenza mostrano come sforzi spostati sull’estremità “effectiveness” dello spettro di prove di efficacia non siano di per sésufficienti a garantire un utilizzo routinario di un’innovazione clinica. Per di più, formazione e monitoraggio sulla eventuale innovazione non bastano a cambiare il comportamento dei providers, come rivelato da una meta-analisi Cochrane15. Quindi, per assicurare un impatto sulla salute pubblica, vanno studiati barriere e facilitatori per innovazioni di comprovata efficacia applicando metodi e strategie rigorose sviluppati nel campo emergente dell’IS (figura 1).
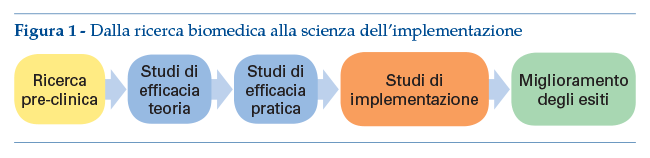
Forse la principale differenza tra ricerca clinica e IS è che quest’ultima si impegna attivamente a capire il contesto in cui viene introdotta un’innovazione clinica, piuttosto che controllarlo o semplicemente tollerarlo.
Mentre gli studi clinici si concentrano sulla comparazione degli effetti sulla salute di un’innovazione rispetto a un gruppo di confronto, gli studi di implementazione si concentrano sulla verifica di strategie che possono aumentare la diffusione e la sostenibilità dell’innovazione6. In termini di popolazione, questi studi sono simili a studi pragmatici di effectiveness, ma l’unità di osservazione può anche essere a livello di provider o di organizzazione16,17. Man mano che si passa da efficacy a implementation studies, gli outcomes (e.g. accettabilità, appropriatezza, fattibilità, costi, sostenibilità) diventano di più breve periodo e relativamente più semplici da misurare, per ridurre al minimo il burden sui rispondenti e trattenere nell’ambito dello studio soggetti di solito meno tolleranti rispetto a un protocollo di ricerca. Negli studi di implementazione il coinvolgimento dei ricercatori nei siti è drasticamente circoscritto, spesso limitato alla formazione di personale “endogeno” all’erogazione e all’utilizzo di indicatori semplici da valutare in remoto.
Progressivamente, assume importanza la misurazione di quella che gli inglesi chiamano fidelity dell’intervento, ovvero adattare appropriatamente al contesto la somministrazione dell’intervento stesso pur mantenendone i componenti principali, stabilendo a priori un piano per caratterizzare cosa ha funzionato e cosa no (“formative evaluation”).
Per semplificare, quindi: il ricercatore clinico stabilisce l’efficacia teorica e reale di un’innovazione, la trasferisce allo scienziato dell’implementazione per testare i modi più efficaci per convincere gli utilizzatori a praticarla. Questa è una sintesi semplicistica perchésuggerisce un flusso unidimensionale di attività. In realtàil processo è molto più iterativo e caratterizzato da adattamenti nell’innovazione stessa per aumentare il livello di validitàesterna, pur preservando l’integritàrispetto ai suoi componenti principali.
Caratteristiche, obiettivi e questioni degli studi di implementazione
Gli“studi di implementazione” (o implementation research studies) strettamente parlando, sono lo strumento di indagine utilizzato dalla scienza dell’implementazione, per valutare (singoli) interventi di implementazione (cioè un metodo per migliorare l’adozione di un “intervento clinico”, come per esempio la formazione/training o un’ispezione/audit) e/o strategie di implementazione (come insieme di più interventi di implementazione) di un intervento sanitario, e non l’intervento sanitario stesso, oggetto di implementazione.
L’essere caratterizzata come Scienza, impone all’IS il ricorso all’approccio “scientifico” nella conduzione degli studi realizzati, la validitàdei risultati ottenuti e la loro generalizzabilità.
Mentre gli studi che valutano l’efficacia dell’intervento sanitario sono di tipo “esplicativo” e vengono svolti in modalitàcontrollate, spesso in sedi o con soggetti accuratamente selezionati, gli studi di implementazione vengono considerati studi“pragmatici” e, al fine di massimizzare la loro generalizzabilità ad altri contesti, vengono realizzati in ambiti eterogenei che, proprio per il tipo di indagine svolta, non possono, e non devono, essere“controllati”o standardizzati.
Pur utilizzando metodologie differenti (di cui si dirànel seguito), in funzione degli obiettivi specifici e del contesto in cui sono svolti, tutti gli studi di implementation research devono rispondere ai principi propri del metodo scientifico, cioè:
• fornire risultati validi e affidabili;
• esplicitare le metodologie utilizzate, affinchésoggetti terzi possano valutare se i processi seguiti siano adeguati, giustifichino le conclusioni raggiunte e siano ripetibili.
Uno studio di implementazione può essere condotto per:
• comprendere le modalità o i motivi per cui pratiche sanitarie, programmi o politiche cliniche e di salute pubblica, di cui si è dimostrata l’efficacia in un contesto sperimentale (evidence-based practice EBP) funzionino o meno nel mondo reale;
• apprendere interventi e strategie di implementazione adeguati a migliorare l’efficacia degli interventi sanitari di cui sopra;
• trasferire conoscenza, informare le parti interessate (operatori, pazienti, decisori, pagatori, policy makers), per migliorare comprensione, trasparenza e responsabilitànell’uso di EBP.
Sulla base di questi obiettivi, gli studi di implementazione acquisiscono dei tratti peculiari in ordine crescente di complessità18 (tabella 1):
• individuare “difetti”, barriere e fattori abilitanti nell’uso di una EBP nella realtà corrente; elaborare ipotesi generali da osservazioni di esempi specifici (Esplorazione o “explore”);
• descrivere il processo di implementazione di interventi sanitari nei contesti del mondo reale, identificare e descrivere le possibili cause agenti sul processo (Descrizione o “describe”);
• verificare se l’introduzione di un intervento sanitario influenza/determina (cioè è associabile causalmente) un miglioramento, come atteso, del risultato di salute e con quale livello di fiducia (“adeguato”, “plausibile”, “probabile”) (Impatto o “influence”);
• comprendere fenomeni complessi sottostanti l’introduzione di una nuova pratica e gli effetti del processo di implementazione sulla pratica stessa (Esplicazione o “explain”);
• prevedere, o aiutare ad anticipare, il possibile risultato dell’introduzione di una EBP (Predizione o “predict”).
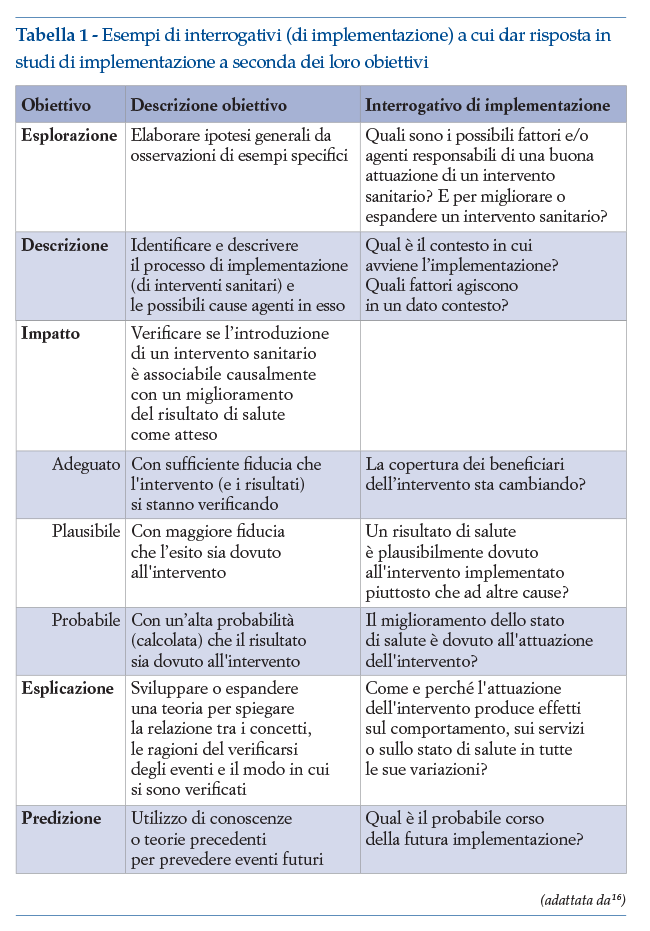
È chiaro che gli obiettivi determinano: la domanda di ricerca da porsi (ovvero la scelta degli interrogativi a cui dare risposta), le variabili da osservare e le loro metodologie di misura, il tipo e il disegno da utilizzare negli studi di implementazione (figura 2).
In particolare, valutazioni funzionali a decisioni programmatiche circa i processi di una strategia di implementazione possono richiedere un livello di fiducia della stima di “adeguatezza o plausibilità” per il gestore o il decisore, e conseguenti metodi che forniscano questi livelli di affidabilità.
Le differenze nel livello di fiducia richiesto determinano il dimensionamento del campione e la necessitàdi introdurre nel disegno gruppi di confronto paralleli o randomizzati.
Tipi e disegni di studio di implementazione
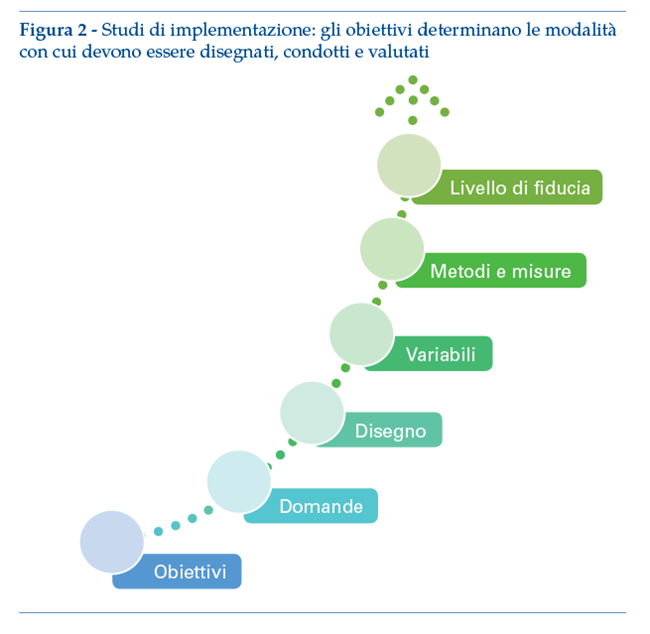
Gli studi di osservazione del processo di implementazione descrivono le caratteristiche di utilizzo di una EBP (o del suo mancato uso) nella pratica corrente. I dati di osservazione vengono raccolti prima, durante e/o dopo l’implementazione dell’intervento sanitario, senza che vi sia un feedback da parte dell’osservatore verso il team che implementa la soluzione e senza alcun intento di modificare il processo in corso. Si tratta di studi di osservazione dei fattori (barriere, facilitatori) che intervengono “spontaneamente” nel contesto in studio. Spesso sono utilizzati per la preparazione o lo sviluppo di una strategia di implementazione dell’intervento.
Gli studi controllati di valutazione dell’efficacia dell’implementazione, in cui il processo di implementazione beneficia del feedback durante lo studio, tipicamente comprensivo di momenti di verifica in itinere e di adattamento del processo, sono svolti al fine di valutare l’efficacia di una strategia di implementazione (che tipicamente prevede attività di formazione/apprendimento).
Disegni tipici di studi controllati sono a gruppi paralleli, randomizzati e prospettici, dove l’unità randomizzata può essere, in funzione dell’obiettivo e della strategia di intervento, il paziente, l’operatore sanitario, l’unitàoperativa, la clinica, la struttura, il servizio sanitario o il sistema stesso.
La randomizzazione può prevedere l’utilizzo in parallelo di diverse strategie di implementazione (per es. una strategia inclusiva di momenti di supporto o formazione verso una strategia che non li prevede), o l’introduzione della medesima strategia di implementazione, ma in tempi diversi dall’inizio dell’implementazione (c.d. disegno“stepped wedge”).
Qualora un disegno randomizzato non sia praticamente realizzabile, oppure politicamente o eticamente accettabile, possono essere utilizzati disegni “quasi-sperimentali”, tra i quali uno dei più robusti19 è quello delle serie temporali interrotte (interrupted time series– ITS) che prevedono la misura in più punti temporali equamente distanziati (ad es. settimanale, mensile o annuale) prima e dopo un intervento di implementazione. Il disegno è particolarmente efficace nel caso in cui sia noto il momento temporale dell’intervento (solitamente possibile) o della strategia (più complicato, a meno che la strategia stessa non consista in un evento discreto, come l’entrata in vigore di una nuova policy).
Poichérisulta infondata anche l’assunzione che un processo ottimizzato di implementazione di una EBP sia sufficiente a garantire un miglioramento del risultato di salute nel contesto “reale” (in contrapposizione all’ambiente controllato in cui gli studi di efficacy ed effectiveness ne hanno dimostrato l’efficacia), per rispondere allo scopo di “migliorare la qualità ed efficacia dei servizi sanitari”, citato come obiettivo finale dell’Implementation Science, è necessario quindi verificare anche l’efficacia sulla salute dell’intervento/EBP implementato nel contesto reale.
Vengono per tal motivo sempre più utilizzati i cosiddetti studi ibridi (di effectiveness-implementazione). La loro caratteristica è di prevedere a priori la valutazione sia dell’efficacia della strategia di implementazione (mediante la valutazione delle variabili di risultato o outcome, dell’implementazione–vedi nel seguito) sia dell’impatto sulla salute dell’intervento sanitario/EBP messo in atto (valutazione di outcome di salute), con un’enfasi potenzialmente diversa sul tipo di valutazione dei due dominii.
In letteratura20,21 vengono indicati tre tipi di studi ibridi:
Studi ibridi di tipo I: verificano l’impatto sulla salute di una EBP, raccogliendo esplicitamente dati sul processo di implementazione per facilitare i successivi sforzi di implementazione. Questo disegno viene tipicamente utilizzato preliminarmente a una prova di implementazione.
Studi ibridi di tipo II: verificano sia gli effetti dell’EBP sui risultati sanitari che gli effetti della strategia di implementazione sull’uso dell’EBP. Tali modelli vengono utilizzati quando c’è un sostanziale “slancio di implementazione” all’interno di un sistema clinico/sanitario, ma i dati sull’efficacia dell’intervento sono ancora in fase di consolidamento o solo indiretti. Pertanto, sia l’impatto della strategia di implementazione sull’utilizzo dell’EBP sia l’impatto dell’EBP sullo stato di salute sono i due obiettivi contemporanei di questi studi.
Studi ibridi di tipo III: verificano la capacità di una strategia di implementazione di migliorare l’uso di una EBP e raccolgono dati sull’impatto sulla salute dell’EBP durante l’implementazione. Questi modelli sono utili quando l’efficacia di un intervento è ben stabilita, ma non è chiaro quanto siano probabili gli effetti (attesi) nelle condizioni di implementazione. Alcuni sostenitori affermano che tutte le prove di implementazione che coinvolgono processi per migliorare i risultati di salute dovrebbero essere ibride di tipo III (figura 3).
Uno studio di implementazione fornisce informazioni su variabili tipicamente divise in22:
• misure quantitative, ottenute mediante survey strutturate e strumenti per valutare attitudine e comportamenti degli attori coinvolti, dati amministrativi, misura delle baseline e delle variazioni nei tassi di utilizzo di certe pratiche. A misure quantitative si associano di solito metodi di analisi quantitativa (es. statistiche descrittive e inferenziali);
• misure qualitative, che aiutano i ricercatori a capire i processi, in particolare quelli che emergono nel tempo, forniscono informazioni dettagliate sull’impostazione o sul contesto ed enfatizzano le voci dei partecipanti attraverso citazioni. Gli strumenti metodologici tipicamente utilizzati sonointerviste semi-strutturate, focus group, osservazioni dirette dei processi (clinici/sanitari), osservazioni etnografiche, revisioni documentali. A misure qualitative si associano metodi di analisi qualitativa (es. coding, identificazione di temi emergenti).
Nella maggior parte dei casi sono impiegati metodi misti, per utilizzare combinazioni di misure quantitative e qualitative, integrandole in modo ottimale anzichétenerle separate, al fine di visualizzare i problemi da più prospettive, sviluppare una comprensione più completa di un problema, con cui gli studiosi di scienze della salute possono studiare nuove domande e iniziative, fenomeni complessi, costrutti e interazioni nello specifico contesto quotidiano, difficili da misurare nelle condizioni sperimentali.
Le fonti dei dati da valutare in uno studio di implementazione possono essere alcuni o tutti gli attori coinvolti nel processo di implementazione, ovvero pazienti, operatori sanitari, organizzazioni, amministrazioni, contesto ambientale, sociale, politico ed economico.
Modelli teorici di riferimento
Dietro il disegno di uno studio di implementazione in realtàdeve esistere una teorizzazione del processo secondo il quale l’implementazione dell’innovazione possa funzionare. La complessità dei contesti in cui avviene l’implementazione, la molteplicità di fattori e livelli di interazione (pazienti, operatori, gruppi, unità organizzative) coinvolti richiedono una comprensione del processo e del contesto, al fine di poter effettivamente ed efficacemente adottare una EBP.
I fattori che possono influenzare l’implementazione di una nuova pratica sono molti, tipicamente interagiscono tra loro, cambiano nel tempo e possono essere valutati in uno studio di implementation research. Una teorizzazione dei fenomeni è quindi richiesta per poter generalizzare l’osservazione specifica del contesto di studio.
Con “teoria” si intende20 una ipotesi circa le relazioni significative tra costrutti (variabili) o su come un meccanismo o un costrutto può cambiare il comportamento di un altro costrutto o risultato.
Una teoria può essere descritta da un “modello” semplificato che fa delle assunzioni circa specifiche relazioni causa-effetto tra variabili. Ogni costrutto nel modello può essere valutato e il modello testato per accettare o confutare la teoria. Sulla base dei risultati, il modello potrebbe richiedere un perfezionamento o essere rifiutato del tutto.
Per esempio, in una teoria del cambiamento si può utilizzare un modello in cui si ipotizza che l’impegno del management si tradurràin risorse sufficienti per l’implementazione e in obiettivi di implementazione articolati dei leader in linea con le priorità organizzative (figura 4). Queste azioni di leadership servono ad aumentare la percezione organizzativa della priorità, che a sua volta porta a risultati di implementazione positivi (ad esempio, alta fedeltà del programma alla sua progettazione prevista).
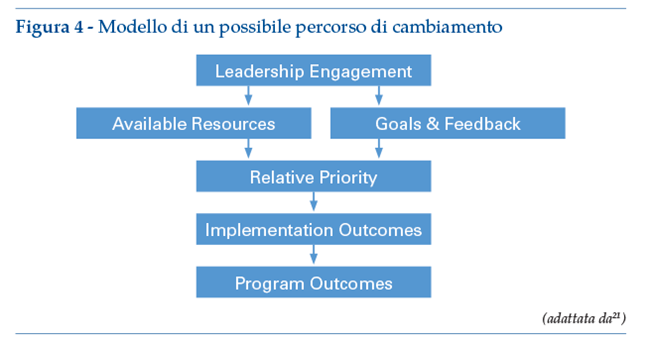
Poiché impostare modelli accurati è complesso, di solito a causa della mancanza di evidenze, vengono spesso utilizzati i framework che forniscono un’ampia serie di costrutti che organizzano concetti e dati in modo descrittivo, senza specificare relazioni causali.
I framework sono utilizzati per concettualizzare e misurare i risultati (outcome) dell’implementazione, tramite variabili di risultato o costrutti, spesso organizzati in dominii che rappresentano indicatori di quanto, e relativamente a quale prospettiva, una certa (strategia di) implementazione stia effettivamente funzionando.
In letteratura sono stati messi a punto e proposti diversi framework che rappresentano una preziosissima risorsa per il disegno e l’esecuzione di studi di implementation research, giacché spesso forniscono una serie prescrittiva di passaggi che riassumono come l’implementazione dovrebbe idealmente essere pianificata ed eseguita.
L’uso sistematico di costrutti ben definiti consente inoltre sintesi più efficienti attraverso l’uso, ad esempio, di tecniche di analisi comparativa qualitativa.
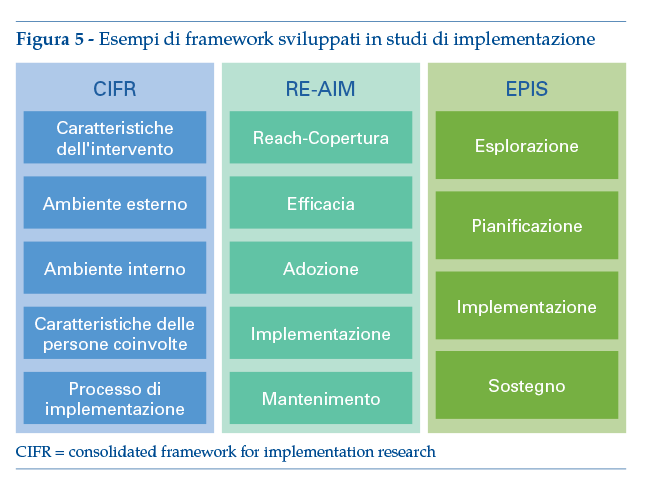
La figura 5 riassume tre esempi rilevanti di framework sviluppati per studi di implementazione, ma si rimanda alla letteratura e ai materiali disponibili sui siti istituzionali specifici dei vari framework per i dettagli.
Framework CIFR (consolidated framework for implementation research)
Sviluppato per consolidare le varie teorie e termini usati nell’Implementation Research (vedasi: https://cfirguide.org/), il modello propone cinque dominii, a ciascuno dei quali vengono associati vari costrutti, che vengono ulteriormente specificati e definiti (di seguito riportati, come esempio, solo per il primo dominio) (figura 6):
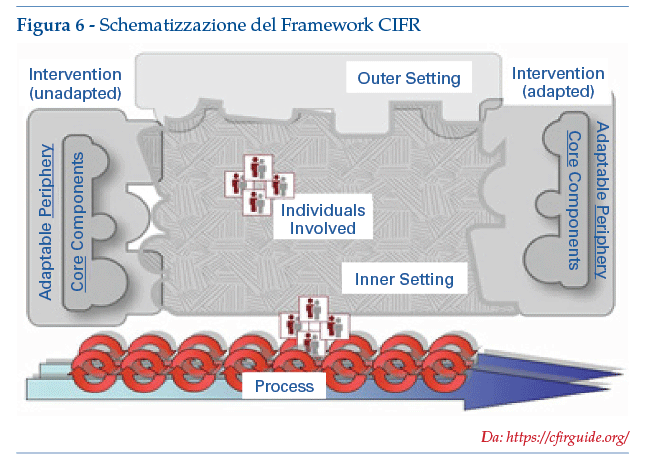
I Caratteristiche dell’intervento: per il quale sono previsti i costrutti di
1.A Fonte dell’intervento
1.B Significativitàe qualitàdelle prove
1.C Vantaggio relativo rispetto a soluzioni alternative
1.D Adattabilità
1.E Verificabilitàsu piccola scala
1.F Complessità
1.G Design, presentazione, assemblaggio
1.H Costi
II Ambiente esterno (per es. bisogni e risorse dei pazienti, policy & incentivi)
III Ambiente interno (per es. organizzazione, sua cultura, coinvolgimento della leadership)
IV Caratteristiche delle persone coinvolte (convinzioni e capacità individuali)
V Processo di implementazione (pianificare, valutare e riflettere).
Framework RE-AIM
Il framework (cfr. https://www.re-aim.org/) consta di cinque elementi, o dimensioni, che si riferiscono agli interventi sul comportamento sanitario. È stato sviluppato per incoraggiare pianificatori di programmi, valutatori, lettori di articoli di riviste, finanziatori e responsabili politici a prestare maggiore attenzione agli elementi essenziali di programmi sanitari, inclusa la validitàesterna, per migliorare l’adozione sostenibile e l’implementazione di interventi “evidence-based”, efficaci e generalizzabili.
È stato utilizzato con successo per tradurre la ricerca in pratica e per aiutare a pianificare programmi e migliorare le loro possibilità di lavorare in contesti “reali”. Il framework è stato utilizzato anche per comprendere i punti di forza e di debolezza dei diversi approcci alla promozione della salute e all’autogestione delle malattie croniche, come la consulenza di persona, i corsi di formazione di gruppo, la consulenza telefonica e le risorse Internet.
L’acronimo RE-AIM indica i cinque passaggi:
1. Reach, ossia copertura– Il numero assoluto, la proporzione e la rappresentativitàdelle persone che sono disposte a partecipare a una determinata iniziativa, intervento o programma e i motivi per cui sì, o perchéno. La questione che ci si pone è “Chi deve essere raggiunto, come raggiungo la popolazione target con l’intervento?”
2. Efficacia– L’impatto di un intervento su risultati individuali, compresi i potenziali effetti negativi, e l’impatto più ampio, compresa la qualitàdella vita e i risultati economici, la variabilitàtra i sottogruppi (generalizzabilità o eterogeneità degli effetti). La questione che ci si pone è “Come faccio a sapere che il mio intervento è efficace?”
3 Adozione– Il numero assoluto, la proporzione e la rappresentativitàdelle strutture e degli agenti di intervento (persone che forniscono il programma) che sono disposti a iniziare un programma e perché. Nota: l’adozione può avere molti livelli (annidati), ad es. personale sotto un supervisore sotto una clinica o una scuola, sotto un sistema, sotto una comunità. La questione che ci si pone è “Come sviluppo il supporto organizzativo per fornire il mio intervento?”.
4. Implementazione– Nell’organizzazione si riferisce alla fedeltàdegli agenti di intervento ai vari elementi delle funzioni o componenti chiave di un intervento, compresi la coerenza della consegna come previsto, il tempo e il costo dell’intervento. È importante sottolineare che include anche gli adattamenti apportati agli interventi e alle strategie di attuazione. La questione è “Come posso assicurarmi che l’intervento venga consegnato correttamente?”.
5. Mantenimento – A livello di organizzazione è la misura in cui un programma o una politica diventa istituzionalizzata o entra a far parte delle pratiche e delle politiche organizzative di routine. A livello individuale, il mantenimento è stato definito come gli effetti a lungo termine di un intervento dopo che un programma di implementazione è stato completato. Domanda: “Come incorporo l’intervento in modo che venga erogato nel lungo termine?”.
Framework EPIS
Proposto in letteratura23 (vedasi anche https://episframework.com/) si articola su quattro fasi, per ciascuna delle quali suggerisce la valutazione di fattori afferenti a quattro dimensioni (contesto interno, contesto esterno, fattori di collegamento, fattori di innovazione) e alle loro inter-correlazioni.
Le fasi sono (figura 7):
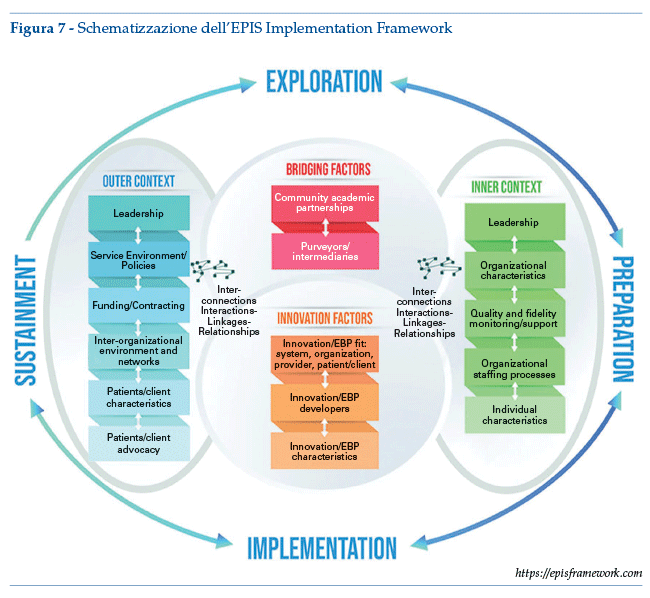
Esplorazione: in cui un sistema di servizi, un’organizzazione, un gruppo di ricerca o altri stakeholder considerano i bisogni di salute emergenti o esistenti dei pazienti, dei clienti o delle comunità e lavorano per identificare le migliori EBP per soddisfare tali bisogni, e successivamente decidono se adottare l’EBP identificato.
Pianificazione:i cui obiettivi primari sono identificare potenziali barriere e facilitatori dell’implementazione nei contesti esterni e interni, valutare ulteriormente le esigenze di adattamento e sviluppare un piano dettagliato per capitalizzare i facilitatori dell’implementazione e affrontare le potenziali barriere.
Implementazione: nella quale l’utilizzo della EBP viene avviato e impiegato nel sistema e/o nell’organizzazione.
Sostegno: durante il quale le strutture, i processi e i supporti del contesto esterno e interno sono organizzati in modo che l’EBP continui a essere erogata, con o senza qualche adattamento, per realizzare il conseguente impatto sulla salute pubblica.
Le variabili di risultato
Per valutare i risultati di una o più strategie di implementazione è dunque necessario specificare quali sono gli aspetti di interesse nella risposta all’implementazione, cioè i risultati con essa ottenuti (ad esempio “l’accettabilità di un intervento”piuttosto che “la diffusione dell’adozione dell’intervento”).
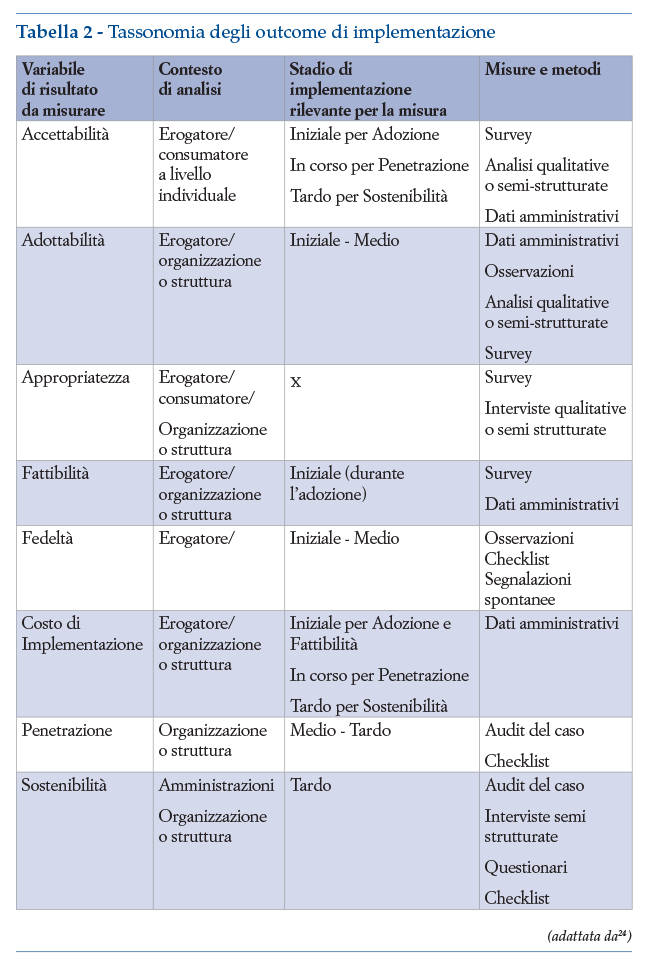
Le variabili di risultato dell’implementazione sono utilizzate come indicatori di quanto bene funzioni una strategia di implementazione. La tassonomia più comunemente utilizzata in letteratura24,25 propone, le seguenti variabili di risultato:
• accettabilità: percezione delle parti interessate (ad es. consumatori/pazienti, fornitori/operatori sanitari, manager, decisori politici) che un intervento è “gradevole/piacevole”, “credibile”, “vantaggioso”;
• adottabilità: l’intenzione, l’intento iniziale o l’impegno a utilizzare il nuovo intervento;
• appropriatezza: l’adeguatezza dell’intervento (o la sua “rilevanza”,“utilità”,“compatibilità”,“praticabilità”) percepita in un particolare contesto o per un particolare pubblico di destinazione (ad esempio fornitore o consumatore) o problema;
• fattibilità: la misura in cui un intervento può essere effettuato (o la sua“praticabilità”, “adeguatezza all’uso quotidiano”) in un particolare contesto od organizzazione;
• fedeltà: il livello di aderenza dell’intervento, o il grado con cui l’intervento è stato implementato come originariamente progettato nel protocollo, piano o policy da adottare;
• costi (della strategia) di implementazione: inteso come i costi incrementali della strategia di implementazione utilizzata nel particolare contesto (mentre il costo totale di implementazione include anche il costo dell’intervento stesso);
• copertura: il grado con cui la popolazione che potrebbe beneficiare dell’intervento lo riceve di fatto (può anche misurare l’accesso al servizio, la diffusione del servizio o l’efficacia della copertura)
• sostenibilità: il grado in cui il servizio viene mantenuto o istituzionalizzato/incorporato/ diventa di routine in un certo contesto.
La tabella 2 riporta una proposta di tassonomia di variabili di risultato vs. contesto di analisi vs. rilevanza per stadio di implementazione vs. tipologie di misura.
Riferimenti bibliografici
1. Morris ZS, Wooding S, Grant J. The answer is 17 years, what is the question: understanding time lags in translational research. J Roy Soc Med 201; 104: 510-20. https://doi.org/10.1258/jrsm.2011.110180.
2. Grant J, Green L, Mason B. Basic research and health: a reassessment of the scientific basis for the support of biomedical science. Res Eval 2003; 12: 217-24. https://doi.org/10.3152/147154403781776618
3. Chalmers I, Glasziou P. Avoidable waste in the production and reporting of research evidence. Lancet 2009; 374: 86-9. https://doi.org/10.1016/S0140-6736(09)60329-9.
4. Greenhalgh T, Robert G, Macfarlane F, et al. Diffusion of innovations in service organizations: systematic review and recommendations. Milbank Q 2004; 82: 581-629.doi:10.1111/j.0887-378X.2004.00325.x
5. Adler PS, Kwon S-W, Singer JMK. The “six-west”problem: Professionals and the intraorganizational diffusion of innovations, with particular reference to the case of hospitals. In Working paper 3-15. Los Angeles, CA: Marshall School of Business, University of Southern California. 2003.
6. Bauer MS, Kirchner J. Implementation science: what is it and why should I care? Psychiatry Res 2020; 283: 112376. doi:10.1016/j.psychres.2019.04.025.
7. Agarwal P, Mukerji G, Desveaux L, et al. Mobile app for improved self-management of type 2 diabetes: multicenter pragmatic randomized controlled trial. JMIR Mhealth Uhealth 2019; 7: e10321.
8. Marshall AD, Hopwood M, Grebely J, Treloar C. Applying a diffusion of innovations framework to the scale-up of direct-acting antiviral therapies for hepatitis C virus infection: identified challenges for widespread implementation. Int J Drug Policy 2020; 86:102964.
9. Colditz GA, Emmons KM. The promise and challenge of dissemination and implementation research. In: Brownson, RC, Colditz GA, Proctor, EK. (Eds.), Dissemination and Implementation Research in Health, second ed. Oxford University Press, Oxford 2018. pp. 1-18.
10. Ferlie E, Fitzgerald L, Wood M, Hawkins C. The nonspread of innovations: the mediating role of professionals. Acad Manag J 2005; 48: 117-34. https://doi.org/10.5465/amj.2005.15993150.
11. Ferlie E, Fitzgerald L, Wood M, Hawkins C. The nonspread of innovations: the mediating role of professionals. Acad Manag J 2005; 48: 117-34. https://doi.org/10.5465/amj.2005.15993150.
12. Dearing JW, Kee KF, Peng T-Q. Historical roots of dissemination and implementation science. In: Brownson RC, Colditz GA, Proctor EK (Eds.), Dissemination and Implementation Research in Health, second ed. Oxford Univ Press, Oxford, 2018 . pp. 47-61.
13. Eccles MP, Mittman BS. Welcome to implementation science. Implement. Sci 2006; 1: 1. https://doi.org/10.1186/1748-5908-1-1.
14. Westfall JM, Mold J, Fagnan L. Practice-based research-“Blue Highways” on the NIH roazMA 2007; 297: 403–6. https://doi.org/10.1001/jama.297.4.403.
15. Ivers N, Jamtvedt G, Flottorp S, et al. Audit and feedback: effects on professional practice and healthcare outcomes. Cochrane Database Syst Rev 2012; 6: CD000259. https://doi.org/10.1002/14651858.CD000259.pub3.
16. Damschroder LJ, Aron DC, Keith RE, et al. Fostering implementation of health services research findings into practice: a consolidated framework for advancing implementation science. Implement Sci 2009; 4: 50. DOI: 10.1186/1748-5908-4-50.
17. Harvey G, Kitson A. PARIHS revisited: from heuristic to integrated framework for successful implementation of knowledge into practice. Implement Sci 2016; 10: 33. https://doi.org/10.1186/s13012-016-0398-2.
18. Peters D H, Adam T, et al. Implementation Research: what it is and how to do it. BMJ 2013; 347: f6753. https://doi.org/10.1136/BMJ.F6753.
19. Hudson J, Fielding S, Ramsay C. Methodology and reporting characteristics of studies using interrupted time series design in healthcare. BMJ 2019; 347: f6753. https://doi.org/10.1136/BMJ.F6753.
20. Curran GM, Bauer M, Mittman B, et al. Effectiveness-implementation hybrid designs: combining elements of clinical effectiveness and implementation research to enhance public health impact. Med Care 2012; 50: 217- 26. https://doi.org/10.1097/MLR.0b013e3182408812.
21. Bauer MS, Damschroder L, Hagedornet H, et al. An introduction to implementation science for the non-specialist. BMC Psychol 2015: 3: 32. https://doi.org/10.1186/s40359-015-0089-9.
22. Creswell JW, Klassen AC, Plano Clark VL, Clegg Smith K. Best practices for mixed methods research in the health sciences. In: Research NIH OBSS. Bethesda: National Institute of Health; 2011.
23. Aarons GA, Hurlburt M, McCue Horwitz S. Advancing a conceptual model of Evidence-Based Practice implementation in public service sectors. Adm Policy Ment Health 2011; 38: 4-23. DOI 10.1007/s10488-010-0327-7.
24. Proctor E, Silmere H, Raghavan R,et al. Outcomes for implementation research: conceptual distinctions, measurement challenges, and research agenda. Adm Policy Ment Health 2011; 38: 65-76. https://doi.org/10.1007/s10488-010-0319-7.
25. Peters DH, Tran N, Adam T, Ghaffar A. Implementation research in health: a practical guide. Alliance for Health Policy and Systems Research, World Health Organization. 2013 https://www.who.int/alliance-hpsr/resources/publications/alliancehpsr_irpguide.pdf?ua=1



