Alice Ravizza1, Oriana Ciani2, Antonio Ferrari3, Sabrina Grigolo4, Francesco Perrone5, Elisabetta Ravot6Eugenio Santoro7Federico Sternini1
1UseMeD, Torino
2CERGAS, SDA Bocconi School of Management, Milano
3IQVIA Ltd, Durham, NC, United States
4Accademia del Paziente Esperto EUPATI Onlus
5Unità Sperimentazioni Cliniche, IRCCS Istituto Nazionale Tumori Fondazione Pascale, Napoli
6Healthware Group, Milano
6Laboratorio di Informatica Medica, Istituto di Ricerche Farmacologiche Mario Negri IRCCS, Milano
Tendenze nuove, Numero Speciale n.01 2021; 71-100: DOI: 10.32032/TENDENZENS20210106.PDF
 Scarica Pdf
Scarica Pdf
1. Valutazione del beneficio clinico
I software che erogano terapie digitali sono dispositivi medici e pertanto devono rispettare, in Europa, i requisiti del Regolamento 2017/745.
Una differenza rilevante tra la MDD (Medical Device Directive) ormai verso la obsolescenza e MDR (Medical Device Regulation), la cui piena applicazione è prevista nel maggio 2021, è costituita dalla richiesta di valutazione dei dati di performance e di beneficio clinico, che viene esplicitata e descritta in dettaglio. La valutazione dell’efficacia del software deve essere basata su dati clinici e su evidenze cliniche. Non è quindi più sufficiente dimostrare che il software “funziona”, ma è anche necessario documentare che esso ottiene, in modo statisticamente significativo, il beneficio clinico per cui è stato progettato. In molti casi, non sarà possibile raccogliere sufficienti evidenze cliniche in letteratura, e sarà quindi necessario eseguire degli studi clinici adeguati.
I progettisti hanno a disposizione, come riferimento, lo standard ISO 14155, che fornisce metodi per la pianificazione ed il monitoraggio dello studio (Clinical investigation of medical devices for human subjects – Good Clinical Practice).
Inoltre, è messa a disposizione di fabbricanti ed autorità regolatorie la linea guida MDCG 2020-1 Guidance on Clinical Evaluation (MDR)/Performance Evaluation (IVDR) of Medical Device Software of March 2020 che fornisce indicazioni dettagliate sugli aspetti di pianificazione della raccolta delle evidenze cliniche e della loro rendicontazione ai fini regolatori.
La linea guida è particolarmente adeguata ad essere applicata a software di diagnosi e monitoraggio, il cui beneficio atteso è la messa a disposizione di informazioni accurate. Ciononostante, vi sono utili informazioni anche per la valutazione clinica di DTx, seppure un approfondimento da parte di MDCG sulle modalità specifiche di valutazione clinica delle terapie digitali appaia a nostro avviso auspicabile.
Innanzitutto, viene confermata la definizione di beneficio clinico (Article 2 (53)) come l’impatto positivo di un dispositivo sulla salute di un individuo, espresso in termini di esiti clinici significativi misurabili e rilevanti per il paziente, inclusi gli esiti relativi alla diagnosi, o un impatto positivo sulla gestione della malattia o sulla salute pubblica.
Lo stesso documento chiarisce la definizione di evidenze cliniche (“I dati clinici e la valutazione clinica (MDR)/valutazione delle prestazioni (IVDR) si riferiscono a un dispositivo in quantità e qualità sufficienti per consentire una valutazione qualificata rispetto alla sicurezza del dispositivo e al fatto che lo stesso dispositivo raggiunga i vantaggi clinici previsti quando usato secondo le indicazioni del produttore”).
Un altro concetto cardine richiamato dalla linea guida MDCG 1 è quello di “valida associazione clinica”. Con questo si intende in che misura si possano associare gli output del software con gli effetti su uno stato fisiologico mirato o su una condizione clinica. Questa associazione deve dimostrare che vi sono robuste relazioni tra i principi scientifici alla base dell’uso del software ed il beneficio atteso.
Inoltre viene inserita una importante definizione di “generalizzabilità” (“La generalizzabilità si riferisce alla capacità di un Medical Device Software/MDSW di estendere le prestazioni previste, testate su una serie specifica di dati, alla popolazione di riferimento più ampia”). Il concetto di generalizzabilità dovrebbe essere preso in considerazione sia quando viene creato un database per la validazione tecnica e pre-clinica del software, sia quando vengono definiti i criteri di inclusione ed esclusione degli studi clinici, e più in generale quando si discute l’implementazione di un dispositivo al di fuori del contesto di studio clinico in cui è stato valutato.
Dal punto di vista della pianificazione, nella maggior parte dei casi lo sviluppo clinico di una terapia digitale (Digital Therapeutics -DTx) include una fase iniziale esplorativa (studi pilota) seguita da una fase di sperimentazione volta a produrre le evidenze di efficacia e sicurezza necessarie per l’approvazione nella specifica indicazione terapeutica (studi pivotal di certificazione CE).
Le caratteristiche degli studi pilota e pivotal delle DTx tendono a riprodurre gli schemi tipicamente adottati nella sperimentazione di interventi terapeutici tradizionali (es. terapia farmacologica, o terapia comportamentale); tuttavia, la natura stessa dell’intervento DTx può richiedere una revisione o un adattamento rispetto agli schemi standard, in particolare per quanto riguarda la scelta degli endpoint, gli indicatori di efficacia utilizzati, l’intervento di controllo, e senza escludere la possibilità della creazione/validazione di indicatori di outcome (clinici, di Health Technology Assessment -HTA etc) specificamente adatti a queste tipologie di prodotto. Fra le principali caratteristiche delle DTx vi è la partecipazione attiva del paziente/caregiver nel percorso di cura. Anche sulla scorta di indicazioni che ne hanno documentato il beneficio, la pianificazione degli studi orientati alla produzione di evidenze per le DTx dovrebbe quindi attentamente considerare le dimensioni riguardanti la selezione e la motivazione dei pazienti e dei caregiver, e auspicabilmente il coinvolgimento di loro rappresentanti già dalla fase di definizione dei progetti di studio(1,2).
2. Panoramica degli studi clinici esistenti
Questa sezione intende fornire una panoramica degli studi disegnati per lo sviluppo di alcuni dispositivi medici identificati come Digital Therapeutics.
Al fine di avere una analisi coerente sono stati estrapolati diversi aspetti quali la presenza di soluzioni di confronto gold standard, la popolazione arruolata, la tipologia di intervento e controllo, e la definizione degli outcome primari.
2.1 Prodotti in fase avanzata
In questa sezione sono analizzati gli studi che hanno fornito evidenze cliniche di efficacia per alcuni prodotti in uno stato avanzato di sviluppo e/o già commercializzati.
Di seguito sono elencati gli studi i cui risultati sono utilizzati dai produttori per dimostrare l’efficacia della soluzione, e per i quali sono disponibili pubblicazioni scientifiche su riviste peer-reviewed o la registrazione sul sito clinicaltrials.gov.
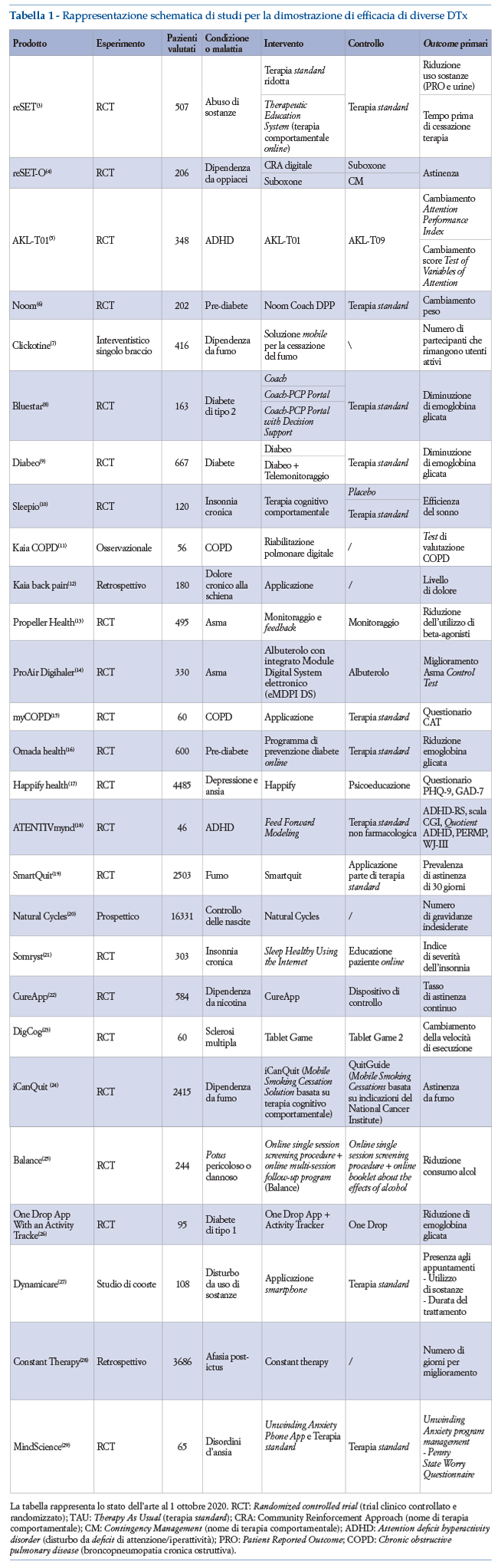
Si può notare che per quanto riguarda i prodotti in fase avanzata di sviluppo, molti di essi hanno completato Randomized Controlled Trials (RCT), con almeno 200 pazienti valutati. Per quanto riguarda gli outcome primari, sono stati considerati parametri fisiologici, comportamenti dei pazienti o risultati di questionari validati. Per quanto concerne il gruppo di controllo, si riscontra la preferenza ad utilizzare la terapia abituale oppure placebo digitali considerati “analoghi” del placebo negli RCT. In particolare, con “placebo digitale” ci si riferisce ad una soluzione digitale comparabile rispetto alla DTx, in termini di contenuti (contiene tutte le informazioni fornite dalla DTx, ma tramite interfacce statiche e non interattive) o di presentazione grafica (presentando stesse interfacce e introducendo la stessa routine di utilizzo dell’applicazione, ma senza elementi responsabili del beneficio clinico).
2.2 Prodotti in fase di sviluppo
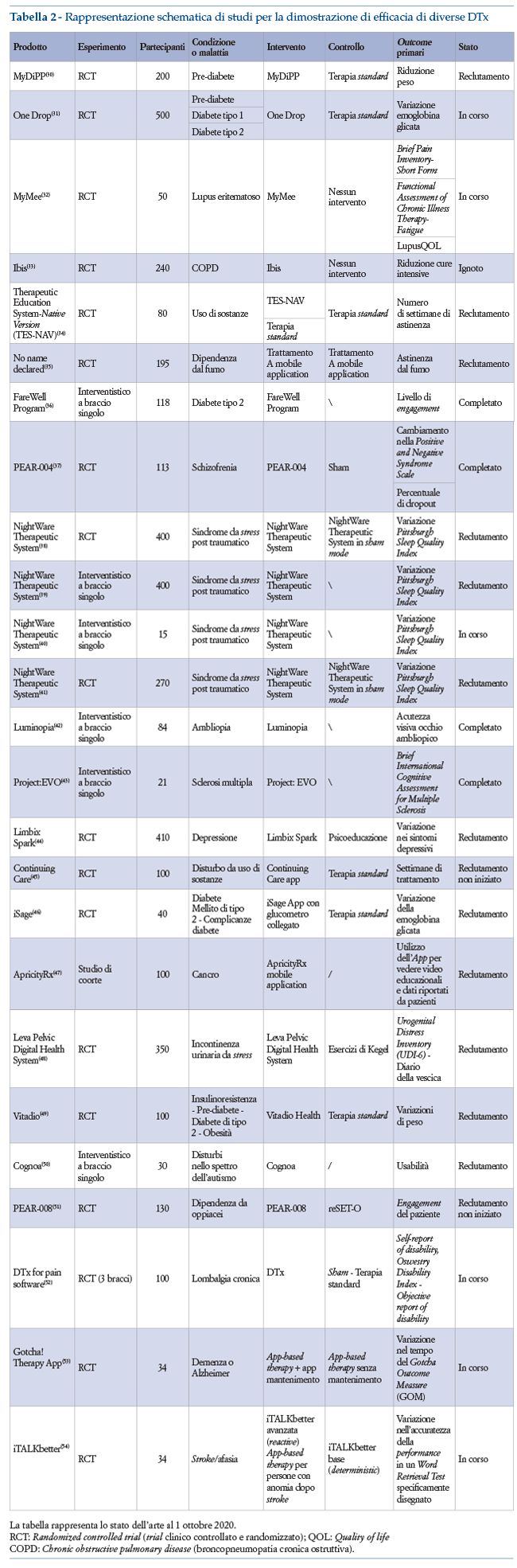
Numerose DTx sono attualmente in fase di sviluppo. Di seguito sono elencati studi completati o in corso, registrati su clinicaltrials.gov.
3. Caratteristiche degli studi pilota
Uno studio “pilota” o studio di fattibilità è uno studio generalmente su piccola scala, utile per verificare se il progetto è adeguato, stabilirne la fattibilità o ricavare informazioni che permettano di determinare la grandezza del campione dello studio allargato (pivotal)(55).
Uno studio pilota, nel caso di software medicali, può essere rilevante in caso di:
• dimostrazione dell’usabilità dell’interfaccia o dei dispositivi hardware associati (per esempio, sensori indossabili);
• creazione di un database di training per intelligenza artificiale;
• definizione, per studi successivi, della popolazione da valutare (inclusa la determinazione del campione), di elementi chiave del disegno dello studio come reclutamento, modalità di randomizzazione e blinding, nonché dell’obiettivo primario e degli endpoint secondari e/o esplorativi;
• dimostrazione e quantificazione della “valida associazione clinica” tra gli output erogati dal software e il beneficio clinico.
Quasi tutti gli studi pilota sono non randomizzati e senza gruppo di controllo. Inoltre, non sempre includono endpoint di efficacia, mentre spesso si concentrano su endpoint di sicurezza.
Di seguito sono illustrati due casi esemplificativi, con ampiezza e caratteristiche diverse.
3.1. Intervento per la cessazione dell’abitudine al fumo (Clickotine)
Caso esemplificativo di studio iniziale condotto su una popolazione ampia di >400 soggetti, in cui sono stati valutati sia outcome di usabilità, sia outcome di efficacia e sicurezza(7).
Clickotine è un’App fruibile su smartphone, disegnata e sviluppata per rilasciare gli elementi essenziali del programma statunitense per la cessazione del fumo USCPG (US Clinical Practice Guideline), ad esempio avvisi e incoraggiamenti per smettere di fumare, valutazione della volontà di smettere, stimoli motivazionali, supporto alla pianificazione, connessione con altri interventi (consulenza, trattamento farmacologico, supporto sociale, linea telefonica dedicata), follow-up.
Nel 2017 sono stati pubblicati i risultati di uno studio iniziale, a singolo braccio, della durata di 8 settimane. Gli outcome misurati erano il coinvolgimento del soggetto (numero di aperture dell’App, numero di interazioni con il programma, settimane attive nel programma), l’efficacia sulla cessazione del fumo (astinenza dal fumo riferita dal paziente a 7 e 30 giorni) e la sicurezza (eventi avversi spontaneamente riferiti e attivamente indagati tramite questionario al termine delle 8 settimane del programma). I dati ottenuti sono stati analizzati mediante opportuni metodi statistici; in aggiunta, sono anche state condotte analisi post hoc, motivate dalla distribuzione non normale della maggior parte delle variabili predittive o delle variabili dicotomiche di outcome. Nel complesso, lo studio ha prodotto dati incoraggianti relativamente al coinvolgimento: in media ogni partecipante ha aperto più di 100 volte l’App durante le 8 settimane (media: 110.6; mediana: 69); i partecipanti hanno avuto numerose interazioni con il programma (media: 214.4; mediana 178) e sono rimasti ingaggiati per una media di 5.3 settimane (mediana: 5 settimane). Inoltre, dopo le 8 settimane, il 45.2% della popolazione intention-to-treat ha riferito un’astinenza dal fumo di 7 giorni e il 26.2% ha riportato un periodo di astinenza di 30 giorni. I pochi eventi avversi segnalati erano in linea con i sintomi da sospensione di nicotina, mentre non sono stati segnalati eventi relativi alla safety riconducibili in maniera specifica al prodotto.
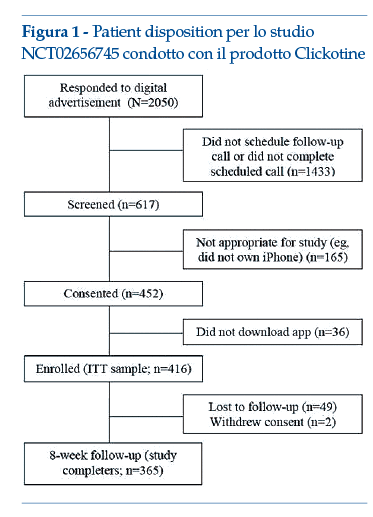
Nella figura 1 è riportata la rappresentazione schematica della flow-chart dello studio (studio registrato in clinicaltrials.gov: NCT02656745).
3.2. Intervento per la gestione del disturbo d’ansia (Unwinding Anxiety)
Caso esemplificativo di studio pilota randomizzato e controllato verso terapia abituale, condotto su una popolazione di circa 60 soggetti (numerosità comune in studi pilota), in cui sono stati valutati sia outcome di ingaggio/accettabilità, sia outcome di efficacia.
Unwinding Anxiety è un programma di intervento comportamentale, fruibile su smartphone o tablet, che si propone di aiutare l’utente nella gestione dell’ansia, inclusi il disturbo d’ansia generalizzata, il disturbo da attacchi di panico, l’ansia sociale. Il programma include video-lezioni, esercizi, contatto settimanale con esperti, stesura di diari (journaling), una community moderata da esperti, momenti quotidiani di verifica.
Unwinding Anxiety ha completato uno studio pilota, randomizzato, controllato verso la sola terapia abituale, in soggetti con disturbo d’ansia generalizzata, con obiettivo di valutare l’ingaggio degli utenti e l’accettabilità, misurare gli effetti dell’intervento in associazione a trattamento abituale vs il solo trattamento abituale, e valutare preliminarmente il meccanismo d’azione. Lo studio ha coinvolto 65 pazienti adulti (di cui 57 sono risultati utili per la valutazione). I criteri di inclusione prevedevano il possesso di uno smartphone e uno score GAD-7 (General Anxiety Disorder-7) pari o superiore a 10.
Le misure di outcome primario erano il numero di moduli completati (per valutare l’ingaggio) e la variazione del grado di preoccupazione secondo il Penn State Worry Questionnaire (PSWQ). Altre misure di outcome includevano l’utilizzo di questionari validati per la valutazione della mindfulness (FFMQ), dell’interocezione (MAIA), del livello di ansia (GAD-7) e dell’accettabilità del programma da parte degli utenti (NPS). L’aspettativa degli sperimentatori è di utilizzare i risultati di questa fase per disegnare un più ampio studio di fase 2 (Studio registrato in clinicaltrials.gov: NCT03683472).
È interessante osservare che, in uno studio indipendente condotto da sperimentatori australiani, Unwinding Anxiety è risultata essere una delle uniche 2 App (su 348 App di salute e benessere valutate) ad aver ottenuto un punteggio di 4 su 5 (massimo punteggio ottenuto). Lo studio ha preso in considerazione parametri multipli incentrati sulla funzionalità e sul potenziale di modificare il comportamento(56).
Inoltre, un recente studio pilota ha investigato gli effetti di Unwinding Anxiety in un campione di medici statunitensi affetti da ansia (N=34), dimostrando una riduzione dell’ansia (GAD-7) pari al 48% dopo 28 moduli (1 mese), e del 57% dopo 3 mesi (p <0.001 in entrambi i casi)(57).
4. Caratteristiche degli studi pivotal
Uno studio “pivotal” è uno studio specificamente progettato per arricchire i dati raccolti durante lo sviluppo e quindi fornire adeguate evidenze cliniche di efficacia e safety per la valutazione da parte di un’agenzia regolatoria. In tutti i casi in cui le evidenze in letteratura non sono sufficienti per la certificazione CE, il fabbricante deve eseguire uno studio pivotal.
In generale, le prove di efficacia per le terapie digitali dovrebbero provenire da studi clinici di elevata qualità, robusti e condotti secondo gli standard promossi dall’evidence based medicine e dalla migliore letteratura metodologica disponibile. Un utile riferimento è rappresentato dall’estensione dei Consolidated Standards of Reporting Trials (CONSORT) a interventi web-based e m-health(58). Inoltre si dovrebbe dimostrare che il software, durante lo studio, è stato testato per tutti gli usi previsti, rispettando la popolazione target, le condizioni d’uso, il funzionamento e l’ambiente d’uso, e con tutti i gruppi di utenti previsti.
Il disegno dello studio deve consentire di raccogliere evidenze statisticamente significative, il che comporta la necessità di fare riferimento a casistiche di adeguata ampiezza, la cui dimensione sia definita a priori sulla base di una ipotesi statistica. Deve anche consentire di documentare quale sia l’eventuale place in therapy del dispositivo, definendo in base a questo quale sia l’appropriato gruppo di controllo. Le caratteristiche del software medicale rendono spesso molto complicati i disegni di studio in cieco, per cui la scelta degli endpoint e delle metriche risulta essere essenziale ai fini dell’affidabilità e consistenza metodologica degli studi.
Si consiglia, in particolare per gli studi pivotal, la realizzazione di studi multicentrici. Oltre a permettere la raccolta di dati da più ospedali/zone geografiche e offrire quindi evidenze maggiormente rappresentative del potenziale target delle DTx, questo approccio avrebbe anche il vantaggio di ridurre le tempistiche di arruolamento per lo studio, una esigenza di particolare importanza per affrontare il rischio di obsolescenza tecnologica dello strumento proposto.
A livello europeo le indicazioni fornite da NICE (The National Institute for Health and Care Excellence, UK) nell’ambito del documento sugli standard di evidenza per le tecnologie di digital health (marzo 2019) possono assumere la funzione di guidare gli sperimentatori.
I requisiti dettati dal NICE per l’evidenza clinica variano a seconda del tipo di intervento che compie il dispositivo, distinguendo se il software è destinato alla prevenzione o se il software produce esso stesso un effetto terapeutico. Nel secondo caso i requisiti sono, come prevedibile, più stringenti.
I software vengono classificati secondo lo schema presente nel documento “Evidence standards for digital health technologies”(59). Le DTx in particolare ricadono nel livello di evidenza 3, che si suddivide a sua volta in 3a e 3b, e secondo il seguente schema:
• se il software viene utilizzato per modificare il comportamento del soggetto, come nel caso della prevenzione e aspetti corollari al trattamento della condizione clinica, viene inserito nella classe 3a;
• se il software viene utilizzato per il trattamento viene inserito nella classe 3b.
Ogni classe deve soddisfare specifici requisiti di evidenza (tabelle 3 e 4), ma è anche necessario che questi rispettino tutte le condizioni dettate per le classi più basse (i requisiti sono quindi cumulativi).
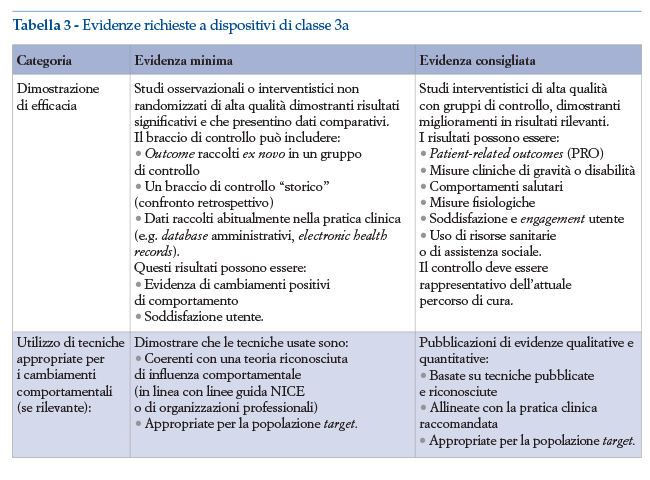

Per questo è importante analizzare anche i requisiti che devono essere rispettati dai dispositivi di prevenzione. I livelli di evidenza indicati dal NICE includono dei livelli minimi di evidenza scientifica e dei livelli consigliati, definiti come “best practices”.
È possibile notare come gli studi di prodotti in stato di sviluppo avanzato (tabella 1) ricadano tutti nella categoria dell’evidenza consigliata per i dispositivi 3b, mentre gli studi pilota possono avere una maggiore flessibilità nella progettazione. Di seguito sono illustrati tre casi esemplificativi di studi pivotal relativi a DTx in fase avanzata di sviluppo. Tutti gli studi sotto riportati hanno dimostrato un beneficio statisticamente significativo della DTx (vs il trattamento di controllo) rispetto agli endpoint primari, rappresentati, nei diversi casi, da endpoint di efficacia clinica o da endpoint associati alla prevenzione rispetto alla patologia di interesse. Da ricordare che tanto la finalità terapeutica quanto quella preventiva sono coerenti con le comuni definizioni di DTx, per esempio quella di Digital Medicine Society/Digital Therapeutic Alliance.
4.1. DTx per deficit di attenzione e iperattività (ADHD)
in età pediatrica (Akili, AKL-T01)
Caso esemplificativo di studio pivotal per DTx utilizzata in monoterapia, controllato verso intervento digitale attivo.
AKL-T01 è un trattamento digitale basato su una interfaccia videogame, sviluppato per il trattamento del disturbo da deficit dell’attenzione ed iperattività (ADHD) pediatrico. Il software agisce inviando stimoli motori e sensori in grado di raggiungere e attivare la corteccia pre-frontale (area cerebrale coinvolta nelle funzioni cognitive). Lo sviluppo clinico si è articolato in vari studi, sino al completamento di uno studio pivotal multicentrico (20 centri), randomizzato, in doppio cieco, controllato verso intervento attivo. Lo studio ha coinvolto 348 bambini di 8-12 anni con diagnosi confermata di ADHD. La DTx era utilizzata in monoterapia (i bambini non assumevano terapia farmacologica, o erano in grado di sospendere un’eventuale terapia farmacologica precedente), l’intervento di controllo era rappresentato da un diverso videogame (AKL-T09); l’endpoint primario era rappresentato dal miglioramento dell’indicatore TOVA-API (Test of Variable Attention Performance Index), misurato al basale e al termine di 4 settimane di studio (terapia circa 25 minuti al giorno, 5 giorni la settimana)(5).

Questo studio è rilevante in quanto ha rappresentato uno dei primi e più rigorosi casi in cui una DTx è stata valutata in un ampio RCT prospettico, con approccio analogo a quanto usualmente effettuato per terapie farmacologiche. In figura 2 è riportata una schematizzazione del disegno dello studio (studio registrato in clinicaltrials.gov: NCT02674633).
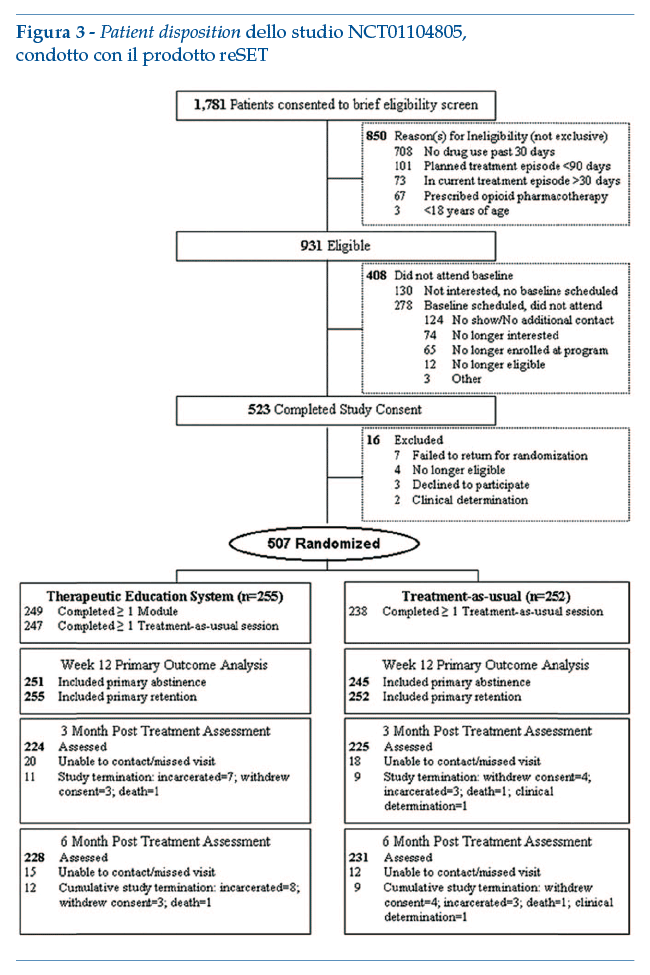
4.2. DTx per il trattamento dell’abuso di sostanze (reSET)
Caso esemplificativo di studio pivotal per DTx utilizzata in associazione a terapia abituale modificata, controllato verso la sola terapia abituale.
reSET è un intervento digitale per il trattamento dell’abuso di sostanze. Consiste in un programma di terapia cognitivo-comportamentale (CBT) della durata di 90 giorni, da somministrarsi come intervento parzialmente sostitutivo della terapia abituale (una parte del trattamento vis-à-vis viene sostituito da reSET) e aggiuntivo alla normale gestione delle contingenze. La soluzione consente di integrare una dashboard per medici e altri operatori sanitari, con informazioni sull’uso di reSET da parte dei pazienti, uso di sostanze riferito dai pazienti e rilevato da dati di laboratorio, e altre informazioni fornite dai pazienti.
Lo studio pivotal, randomizzato, controllato, multicentrico (10 centri) ha coinvolto inizialmente 1.781 soggetti adulti, 507 dei quali sono stati randomizzati a ricevere la sola terapia abituale o reSET in associazione a un programma di terapia abituale modificata (ridotta). La componente reSET poteva essere fruita dal partecipante su computer presenti nei centri o autonomamente al di fuori del centro. Gli outcome primari pre-specificati erano l’astinenza da droghe pesanti o alcool nelle ultime 4 settimane (auto-riferita o basata su analisi delle urine)(3).
Lo studio ha evidenziato la significatività statistica dell’aumento della probabilità di astinenza per i soggetti che fanno uso di stimolanti. In particolare, i pazienti trattati con reSET hanno avuto una minore riduzione del drop-out dal trattamento rispetto al trattamento abituale (Hazard Ratio=0.72 [IC 95% CI, 0.57-0.92], p=0.010), oltre ad un incremento del periodo di astinenza (Odds Ratio=1.62 [IC 95%: 1.12-2.35], p=0.010); l’effetto era più marcato nei pazienti che, al momento dello screening iniziale per l’ingresso nello studio, presentavano un campione di urina positivo per la presenza di sostanze e/o positività al breath-test per l’alcool (n=228) (Odds Ratio=2.18 [IC 95%: 1.30-3.68], p=0.003).
Di seguito il diagramma di flusso relativo all’arruolamento e disegno dello studio (studio registrato in clinicaltrials.gov: NCT01104805):
4.3. Intervento digitale per la prevenzione del diabete (Noom Coach app)
Caso esemplificativo di RCT per un programma digitale di coaching con finalità preventiva.
Noom Coach app è un intervento di coaching virtuale che eroga un programma di prevenzione del diabete (DPP) attraverso un’interfaccia interattiva. L’App include funzioni di messaggistica tra coach e partecipante, messaggi di gruppo, supporto alle modifiche comportamentali attraverso l’impostazione di sfide quotidiane, articoli educazionali sul DPP, input relativo al consumo di alimenti e feedback automatico rispetto alle scelte alimentari. Dopo un’ampia fase pilota, è stato recentemente completato un RCT che ha coinvolto 202 partecipanti adulti e il cui obiettivo primario era valutare l’efficacia della piattaforma mobile Noom Coach DPP rispetto all’intervento medico abituale (i partecipanti erano liberi di cercare assistenza o supporto medico durante lo studio, oltre ad avere a disposizione una versione cartacea del DPP)(6). Obiettivo primario era la modifica del peso corporeo misurato al basale, dopo 6 mesi e al termine dello studio (durata complessiva 52 settimane); ulteriori obiettivi includevano le variazioni nei livelli di emoglobina glicosilata (HbA1c), la variazione della produttività lavorativa (attraverso questionario validato), la variazione della qualità di vita (attraverso questionario CDC HRQOL-4).
5. Valutazione del profilo di sicurezza
Accanto alla valutazione del beneficio, gli studi pivotal (in alternativa “le sperimentazioni cliniche randomizzate”) forniscono in genere informazioni anche sui possibili effetti collaterali associati al (nuovo) trattamento in fase di valutazione. Questa misura, insieme a quella del beneficio, serve a determinarne la tollerabilità e quindi a valutare il rapporto rischio/beneficio del nuovo trattamento.
Anche gli interventi di DTx possono provocare effetti indesiderati. Sono in genere meno gravi rispetto a quelli causati dai farmaci tradizionali, spesso più gestibili, ma possono presentarsi in misura maggiore rispetto ai rispettivi bracci di controllo e non devono comunque in ogni caso essere sottovalutati.
Per esempio, uno studio che ha dimostrato l’efficacia dell’intervento digitale per la cessazione da fumo ha evidenziato in due pazienti la comparsa di effetti collaterali (cambiamento dell’umore, incubo) probabilmente associati al trattamento e, in pochi altri casi, affaticamento (non associato al trattamento)(7).
Di recente, nell’illustrare i benefici di Endeavor (precedentemente noto con il codice sperimentale AKL-T01), la terapia digitale basata sui videogiochi per il trattamento di bambini con diagnosi di Disturbo da Deficit Attentivo con Iperattività e che ha ricevuto nel giugno 2020 l’autorizzazione alla commercializzazione da parte di FDA, non sono stati segnalati eventi avversi gravi associati al trattamento digitale. Tuttavia, nel 9.3% dei casi, i pazienti trattati negli studi hanno presentato eventi avversi non gravi (associati al trattamento digitale), tra cui senso di frustrazione, mal di testa, vertigini, reazioni emotive, nausea o aggressività(60).
Gli effetti avversi associabili alle terapie digitali vanno comunque misurati e valutati. Non sempre tuttavia sono evidenziati eventi imputabili all’intervento digitale. Per esempio, in uno studio randomizzato per misurare l’efficacia dell’intervento digitale nella gestione di pazienti diabetici si è osservato che eventi ipoglicemici, ricoveri e visite al Pronto Soccorso avevano una bassa percentuale, del tutto sovrapponibile a quella riscontrata nel gruppo di controllo, e che tali eventi avversi non erano correlati allo studio(8).
Come accade per le terapie tradizionali, un’attenta valutazione degli effetti indesiderati associabili all’intervento digitale potrà avvenire con l’attivazione degli studi post-marketing (gli studi di fase IV), una volta che la terapia digitale sia stata immessa sul mercato, così da ottenere informazioni su popolazioni più ampie ed eterogenee, esulla sicurezza nel lungo termine.
Altrettanto interessante e forse più rilevante è il tema dei drop-out, di coloro cioè che interrompono il trattamento (digitale) prima della conclusione della sperimentazione clinica. In uno studio per la valutazione dell’efficacia di una terapia digitale per il trattamento del dolore in pazienti con lombalgia, si è assistito a un progressivo abbandono dell’intervento da parte dei pazienti prima della conclusione dello studio(12). Dopo 8 settimane di trattamento con la terapia digitale i pazienti rimasti aderenti alla terapia erano il 32% della popolazione in studio, mentre al termine dello studio (12 settimane) erano calati al 18%.
Una particolare attenzione al design dell’intervento digitale, un maggiore coinvolgimento dei pazienti nel suo sviluppo, una aumentata attenzione ai feedback degli utenti, un maggiore loro engagement grazie a promemoria, e-mail, SMS e messaggi, sono aspetti che dovrebbero essere presi in considerazioni per ridurre al massimo questo fenomeno.
6. Il ruolo dei Comitati Etici
Per favorire un sistema che possa consentire all’Italia di contribuire in maniera significativa allo sviluppo di DTx, i Comitati Etici devono disporre di adeguato know-how e di specifiche linee guida, in considerazione del fatto che la sperimentazione di una DTx può differire significativamente sia da quella di un farmaco, sia da quella di un dispositivo medico “tradizionale” (ad esempio una protesi articolare) che i Comitati Etici sono abituati a valutare.
Il disegno degli studi con DTx deve garantire la protezione dei dati sensibili e permettere di gestire la rapida evoluzione tecnologica alla quale sono sottoposte.
In tale prospettiva, le principali criticità riguardano il controllo del cambiamento del prodotto nel corso dello studio e il salvataggio dei dati relativi allo studio stesso. A causa della rapidità di evoluzione del dispositivo software stand-alone, sono probabili frequenti aggiornamenti di versione del dispositivo nel corso dello svolgimento dello studio.
Il fabbricante pertanto deve prevedere per il protocollo di ricerca stesso e per il prodotto una serie di modifiche attese (“change control”) che non richiedano l’approvazione del Comitato Etico e dell’Autorità Competente, perché relative a “manutenzione perfettiva” (cosiddetto “bugfix”) oppure perché sono modifiche relative ad aspetti di usabilità e non ad aspetti clinici o ancora ad aspetti tecnici inderogabili (per esempio, aggiornamento della piattaforma Android/iOs di una App medicale).
7. Sorveglianza post-marketing
Già dalla prima emissione del certificato CE, il fabbricante della DTx è tenuto a pianificare una di raccolta dei dati clinici post-marketing. Per definizione, questi studi devono essere eseguiti rispettando le indicazioni d’uso e sulla popolazione di pazienti per cui il dispositivo è già certificato: non possono essere quindi utilizzati per testare nuove applicazioni cliniche del software ed hanno come scopo quello di confermare il rapporto rischi/benefici e di raccogliere informazioni relative all’utilizzo su larga scala. In tale prospettiva, gli studi di sorveglianza post-marketing offrono una ottima possibilità di raccogliere importanti informazioni in termini di aderenza e “user experience”.
Il Regolamento MDR incoraggia l’uso dei risultati degli studi di follow-up per fornire nuove informazioni per migliorare e aggiornare il software. Risulta quindi particolarmente virtuoso, per esempio, l’utilizzo di studi post-marketing, con adeguato controllo, per aumentare il database di training di una intelligenza artificiale medicale.
La natura stessa della DTx permette una raccolta dati massiva nella fase post-commercializzazione del dispositivo. I produttori dovrebbero quindi mettere in pratica misure di raccolta dati clinici real-world, rispettando la privacy dei pazienti.
Un esempio virtuoso di questa prassi di raccolta dati è Natural Cycles, una DTx per il controllo delle nascite. Tramite l’utilizzo del dispositivo sono stati raccolti dati in diversi studi clinici osservazionali e retrospettivi per stimare l’efficacia del dispositivo sia in utilizzo sperimentale che in utilizzo nel mondo reale(20, 61-63). Inoltre, dai dati ottenuti, il fabbricante ha avuto la possibilità di ottenere ulteriori indicazioni che esulano dalla dimostrazione di efficacia del dispositivo, ma legate ad attività direttamente connesse con l’uso del dispositivo, permettendo di condividere importanti informazioni di interesse scientifico(64, 65).
Il sistema di raccolta dati del fabbricante dovrebbe inoltre tenere conto degli effetti sulla salute del paziente nelle fasi successive all’interruzione del trattamento.
8. Massime modifiche accettabili alla DTx che non richiedano
inizio ex-novo della validazione clinica
Come precedentemente sottolineato, una peculiarità di prodotti come le DTx, rispetto per esempio al farmaco o a dispositivi medici di altra natura, è la possibilità di andare incontro a rapide evoluzioni tecnologiche che possono intervenire durante le fasi di validazione clinica. Si tratta di un argomento di particolare delicatezza e per il quale sarebbe opportuno prevedere linee di indirizzo comportamentale sufficientemente chiare e definite.
In tal senso, una proposta che si ritiene sostanzialmente condivisibile è quella avanzata dai “Leaders in mHealth research, industry and health care systems from around the globe” e riportata nell’articolo di Torous et al. “Towards a consensus around standards for smartphone apps and digital mental health”(66). Nello specifico, i principali contenuti della proposta sono:
“Changes in technology may mean that app updates need to be re-evaluated for their efficacy. Small cosmetic changes, platform changes and aspect changes do not likely require a retest of an intervention, as long as the therapeutic principle that has been evaluated remains intact. ………However, significant changes, such as adding a new therapeutic principle or substantial changes to that principle, must demonstrate efficacy through the same evaluation pathways as novel therapeutics.
Our recommendations are:
a. newly adapted therapeutic principles, which should be identified and defined, must undergo controlled clinical trials to determine their efficacy and effectiveness;
b. small changes to an app with an evidence base need not undergo another clinical trial, but any major change requires a re-evaluation of app effectiveness”.
Sulla base di questi principi generali è peraltro fondamentale comprendere quali possano essere le modifiche “significant” o “small” che impongano o meno una rivalutazione degli effetti del prodotto.
Il fabbricante quindi deve definire delle politiche che includano la definizione dell’impatto delle modifiche sul dispositivo basate sull’analisi di rischio del dispositivo. Di seguito è presentato un esempio applicabile a molte DTx:
a. Modifica di tipo “Major”:
• qualsiasi variazione che abbia potenzialmente un impatto in termini di sicurezza, efficacia, caratteristiche di rischio del sistema software (esempio, viene creato un nuovo database di training con diversi indicatori clinici);
• qualsiasi variazione nell’uso previsto, per esempio:
• utilizzare il sistema per una diversa popolazione di pazienti
• il sistema viene integrato con un modulo che fornisce un mezzo per la segnalazione di emergenza clinica
• il sistema viene integrato con un modulo per gestire la interazione con dispositivi indossabili
• cambia il metodo di interazione con il paziente, introducendo l’interazione vocale
• il sistema viene integrato con un nuovo parametro misurabile aggiuntivo utilizzato come input per l’algoritmo;
• qualsiasi variazione nella struttura architettonica principale, intesa come una modifica dell’organizzazione dei moduli e degli elementi software che vada a modificare il flusso dei dati necessari per l’uso medico previsto, oppure che vada a modificare la segmentazione (per esempio il passaggio da un sistema basato su App scaricabile in locale a un sistema basato principalmente su cloud);
• qualsiasi variazione che potrebbe causare incompatibilità tra i moduli oppure con i sistemi di interfaccia (database o sistema operativo).
b. Modifica di tipo “Minor”
• qualsiasi modifica non inclusa nella definizione Major, per esempio
• miglioramento delle prestazioni, senza modifiche all’uso previsto o nuovi tipi di input
• aggiornamento del database di formazione o di quello di convalida, con dati comparabili, in termini di qualità e contenuti informativi, rispetto a quelli utilizzati nella versione precedente;
• modifiche relative agli input di accesso, logistici o gestionali, senza variazioni dell’uso previsto, per esempio
• nuovi mezzi per identificare l’utente (esempio biometria anziché password)
• inserimento dati tramite comando vocale da parte dell’utente professionale;
• aggiornamento dell’interfaccia utente, nuove icone
• traduzioni
• aggiornamento del manuale dell’utente
• modifiche o integrazioni a SOUP (Software Of Unknown Provenance) non critiche
• Bot per assistenza tecnica a pazienti/utenti professionali, ad esempio per l’assistenza al cambio password.
Ogni modifica così classificata deve poi essere interpretata e analizzata quando proposta all’interno di una sperimentazione clinica:
• nel caso di una modifica “Major”, essa dovrebbe essere valutata nel dettaglio, per identificare se la modifica sia completamente non accettabile oppure se le informazioni raccolte con il prodotto nella versione precedente sono ancora parzialmente significative;
• le modifiche “Minor”, che come detto, dovrebbero essere accettabili e non comportare inizio ex-novo del processo di validazione, possono essere comunicate agli Investigatori e formalizzate tramite aggiornamento della Investigator’s Brochure, ed eventualmente agli utenti (per esempio nel caso di modifiche minori dell’interfaccia, e in tal caso potrebbero essere indicate eventuali attività di formazione per garantire che l’utilizzatore sia in grado di continuare ad utilizzare il prodotto);
• i bugfix sono da considerare accettabili e dovrebbero essere comunicati agli Investigatori e agli utenti con notifiche automatiche (esempio: notifiche in-App).
What is known
• I software che erogano terapie digitali (DTx) sono dispositivi medici e pertanto devono rispettare, in Europa, i requisiti del Regolamento 2017/745
• Il Regolamento stabilisce sia necessario dimostrare un beneficio clinico, attraverso una indagine clinica, senza però fornire dettagli circa le caratteristiche di questa indagine
• Esistono ad oggi alcuni esempi di DTx approvate, tante altre sono in fase di sviluppo. Il livello di evidenza disponibile o in via di generazione è variabile
• La valutazione del beneficio clinico, per le DTX, deve basarsi su evidenze cliniche dimostrabili e statisticamente significative nel migliorare uno specifico obiettivo di salute che sia misurabile. La novità ed innovatività di queste tecnologie non devono portare a facili entusiasmi, poiché non tutto ciò che è tecnologicamente avanzato è automaticamente utile, efficace e costo-efficace, almeno quanto se non più di quanto offerto dai metodi tradizionali
• I metodi tradizionali di ricerca delle evidenze possono non essere perfetti né applicabili tout-court alle DTx, ma deve essere chiaro l’obiettivo di raggiungere una esaustiva descrizione del rapporto rischio-beneficio e una buona conoscenza di ciò che può essere ragionevolmente previsto in termini di uso clinico.
What is uncertain
• In assenza di prescrizioni precise nel Regolamento, non è chiaro quali caratteristiche avranno gli studi clinici a supporto della certificazione di DTx in Italia e in Europa
• Le DTx presentano peculiarità che richiedono alcune accortezze in fase di disegno di studio, se si vuole raggiungere una esaustiva caratterizzazione del profilo rischio-beneficio: la scelta del controllo, le metriche per misurare gli esiti in termini di efficacia e sicurezza devono essere spesso “personalizzate” caso per caso.
What we recommend
• Avviare un approfondimento di tipo regolatorio a livello europeo relativamente alle indagini cliniche per le DTx, così da garantire, per un dispositivo a finalità terapeutica, standard di efficacia e sicurezza adeguati e uniformi
• Per consentire agli sviluppatori di raccogliere chiare evidenze sul beneficio, e alle Autorità regolatorie di poter valutare correttamente queste evidenze, si auspica:
• che i benefici clinici possano essere espressi con metriche adeguate non solo all’indicazione d’uso prevista, ma anche alla tecnologia;
• che la scelta di un eventuale controllo in uno studio sia giustificata non solo in termini clinici ma anche tecnici (ad esempio, nel caso di una DTx per terapia cognitivo-comportamentale, il controllo potrebbe essere un farmaco, una terapia cognitivo-comportamentale in presenza o in telemedicina, oppure un normale videogioco);
• che nel protocollo clinico sia possibile definire la “pipeline” dei possibili cambiamenti tecnici, di interfaccia e di architettura software attesi, e per ciascuno di essi sia definita una politica di impatto sull’andamento dello studio stesso;
• che il numero di pazienti reclutati sia adeguato per mostrare i possibili vantaggi di DTx rispetto al braccio di controllo;
• che siano attivate strategie di coinvolgimento dei pazienti (engagement), per ottimizzare la pianificazione e conduzione dello studio (es. limitare il numero di possibili abbandoni dagli studi/drop out) e selezionarne gli obiettivi maggiormente in grado di rispondere alle esigenze dei pazienti;
• che siano proposti dei piani di validazione clinica che tengano conto degli effetti collaterali a lungo termine
• Si raccomanda inoltre che gli studi clinici riguardanti DTx possano essere valutati con il contributo delle diverse Autorità Regolatorie, con ad esempio l’intervento di European Medicines Agency (EMA) se la DTx viene confrontata con un farmaco, oppure se ha una destinazione d’uso simile o identica a un farmaco.
Riferimenti bibliografici
1. O’Connor S, Hanlon P, O’Donnell CA, et al. Barriers and facilitators to patient and public engagement and recruitment to digital health interventions: protocol of a systematic review of qualitative studies. BMJ Open 2016; 6: e010895.
2. Putrino D, Zanders H, Hamilton T, et al. Patient engagement is related to impairment reduction during digital game-based therapy in stroke. Games Health J 2017; 6: 295-302.
3. Campbell AN, Nunes EV, Matthews AG, et al. Internet-delivered treatment for substance abuse: a multi-site randomized controlled clinical trial. Am J Psychiatry 2014; 171: 683-90.
4. Christensen DR, Landes RD, Jackson L, et al. Adding an Internet-delivered treatment to an efficacious treatment package for opioid dependence. J Consult Clin Psychol 2014; 82: 964-72.
5. Kollins SH, Bower J, Findling RL, et al. 2.40 A multicenter, randomized, active-control registration trial of software treatment for actively reducing severity of ADHD (Stars-Adhd) to assess the efficacy and safety of a novel, home-based, digital treatment for pediatric ADHD. J ACAAP 2018; 57: S172.
6. Prevention of Diabetes Using Mobile-enabled, Virtual Delivery of the National Diabetes Prevention Program. https://clinicaltrials.gov/ct2/show/NCT03865342. I risultati di precedente studio pilota sono pubblicati come: Michaelides A, Major J, Pienkosz E Jr, Wood M, Kim Y, Toro-Ramos T. Usefulness of a novel mobile diabetes prevention program delivery platform with human coaching: 65-week observational follow-up. JMIR Mhealth Uhealth 2018; 6: e93.
8. Quinn CC, Shardell MD, Terrin ML, et al. Cluster-randomized trial of a mobile phone personalized behavioral intervention for blood glucose control. Diabetes Care 2011; 34: 1934-42.
9. Jeandidier N, Chaillous L, Franc S, et al. DIABEO App software and telemedicine versus usual follow-up in the treatment of diabetic patients: protocol for the TELESAGE randomized controlled trial. JMIR Res Protoc 2018; 7: e66.
10. Espie CA, Kyle SD, Williams C, et al. A randomized, placebo-controlled trial of online cognitive behavioral therapy for chronic insomnia disorder delivered via an automated media-rich web application. Sleep 2012; 35: 769-81.
11. Rassouli F, Boutellier D, Duss J, et al. Digitalizing multidisciplinary pulmonary rehabilitation in COPD with a smartphone application: an international observational pilot study. Int J Chron Obstruct Pulmon Dis 2018; 13: 3831-6.
12. Huber S, Priebe JA, Baumann KM, et al. Treatment of low back pain with a digital multidisciplinary pain treatment App: short-term results. JMIR Rehabil Assist Technol 2017; 4: e11.
13. Merchant RK, Inamdar R, Quade RC. Effectiveness of population health management using the Propeller Health Asthma Platform: a randomized clinical trial. J Allergy Clin Immunol Pract 2016; 4: 455-63.
14. A 12-week treatment study to evaluate the effectiveness of albuterol multidose dry powder inhaler with integrated electronic Module Digital System (eMDPI DS) in patients 13 years or older with asthma. https://clinicaltrials.gov/ct2/show/NCT03890666.
15. Clinical efficacy and cost effectiveness of MYCOPD in patients with mild and moderate newly diagnosed COPD. https://clinicaltrials.gov/ct2/show/NCT03620630.
16. Preventing diabetes with digital health and coaching. https://clinicaltrials.gov/ct2/show/NCT03312764.
17. Parks AC, Williams AL, Tugade MM, et al. Testing a scalable web and smartphone based intervention to improve depression, anxiety, and resilience: a randomized controlled trial. Int J Wellbeing 2018; 2: 8.
18. McDermott AF, Rose M, Norris T, Gordon EA. Novel feed-forward modeling system leads to sustained improvements in attention and academic performance. J Atten Disord 2016; 1087054715623044. doi:10.1177/1087054715623044.
19. Trial of an innovative smartphone intervention for smoking cessation. https://clinicaltrials.gov/ct2/show/NCT02724462.
20. Bull J, Rowland S, Lundberg O, et al. Typical use effectiveness of Natural Cycles: postmarket surveillance study investigating the impact of previous contraceptive choice on the risk of unintended pregnancy. BMJ Open 2019; 9: e026474.
21. Ritterband LM, Thorndike FP, Ingersoll KS, et al. Effect of a web-based cognitive behavior therapy for insomnia intervention with 1-year follow-up: a randomized clinical trial. JAMA Psychiatry 2017; 74: 68-75.
22. Masaki K, Tateno H, Nomura A, et al. A randomized controlled trial of a smoking cessation smartphone application with a carbon monoxide checker. NPJ Digit Med 2020; 3: 35.
23. Bove R, Rowles W, Zhao C, et al. A novel in-home digital treatment to improve processing speed in people with multiple sclerosis: a pilot study. Mult Scler 2020; 1352458520930371. doi: 10.1177/1352458520930371.
24. Bricker JB, Watson NL, Mull KE, et al. Efficacy of smartphone applications for smoking cessation: a randomized clinical trial. JAMA Intern Med 2020; e204055. doi: 10.1001/jamainternmed.2020.4055.
25. Brendryen H, Lund IO, Johansen AB, et al. Balance–a pragmatic randomized controlled trial of an online intensive self-help alcohol intervention. Addiction 2014; 109: 218-26.
26. Osborn CY, Hirsch A, Sears LE, et al. One Drop App With an Activity Tracker for adults with type 1 diabetes: randomized controlled trial. JMIR Mhealth Uhealth 2020; 8: e16745.
27. Contingency management using smartphone App in patients with SUD. https://clinicaltrials.gov/ct2/show/NCT04162132.
28. Braley M. A parallel, virtual, randomized trial of PCT for speech, language, and cognitive intervention in stroke patients. https://clinicaltrials.gov/ct2/show/study/NCT04488029 (2020).
29. Developing a novel digital therapeutic for the treatment of generalized anxiety disorder. https://clinicaltrials.gov/ct2/show/NCT03683472.
30. A digital therapy for diabetes prevention among overweight adults in Terengganu, Malaysia. https://clinicaltrials.gov/ct2/show/NCT03997656.
31. Fit-One: A trial evaluating the effect of One Drop and Fitbit on diabetes and pre-diabetes outcomes. https://clinicaltrials.gov/ct2/show/NCT03459573.
32. FLARE Lupus Research Study Systemic Lupus Erythematosus. https://clinicaltrials.gov/ct2/show/NCT03426384.
33. Impact of Ibis on patients with advanced COPD. https://clinicaltrials.gov/ct2/show/NCT03131622
34. Web-based addiction treatment: cultural adaptation with American Indians. https://clinicaltrials.gov/ct2/show/NCT03363256.
35. Innovative digital therapeutic for smoking cessation. https://clinicaltrials.gov/ct2/show/NCT03694327.
36. Effectiveness of a digital therapeutic on type 2 diabetes. https://clinicaltrials.gov/ct2/show/NCT03369626.
37. Study of efficacy of PEAR-004 in schizophrenia. https://clinicaltrials.gov/ct2/show/NCT03751280.
38. Remote study of NightWare for PTSD with nightmares. https://clinicaltrials.gov/ct2/show/NCT03934658.
39. NightWare Open Enrollment Study. https://clinicaltrials.gov/ct2/show/NCT03828656.
40. Traumatic nightmares treated by NightWare (to arouse not awaken). https://clinicaltrials.gov/ct2/show/NCT03795987.
41. Traumatic nightmares treated by NightWare (to arouse not awaken). https://clinicaltrials.gov/ct2/show/NCT04040387.
42. Luminopia VR Device Pilot Study. https://clinicaltrials.gov/ct2/show/NCT02782117.
43. Bove RM, Rush G, Zhao C, et al. A videogame-based digital therapeutic to improve processing speed in people with multiple sclerosis: a feasibility study. Neurol Ther 2019; 8: 135-45.
44. Limbix Health, Inc. Limbix Spark: A CBT-based mobile intervention as first line treatment for adolescent depression during COVID-19. https://clinicaltrials.gov/ct2/show/study/NCT04524598 (2020)
45. Continuing Care App for probationers and parolees. https://clinicaltrials.gov/ct2/show/NCT04574193.
46. mHealth titration and management. https://clinicaltrials.gov/ct2/show/NCT03908762.
47. Apricity Health, LLC. A study of ApricityRx™ digital therapeutic for management of immune-related adverse events in patients on immuno-oncology therapy. https://clinicaltrials.gov/ct2/show/study/NCT04571398 (2020).
48. Pelvic floor muscle training with a digital therapeutic device to standard exercises for stress urinary incontinence. https://clinicaltrials.gov/ct2/show/NCT04508153.
49. Impact of digital therapeutic on metabolic parameters. https://clinicaltrials.gov/ct2/show/NCT04573296.
50. Cognoa, Inc. Cognoa ASD digital therapeutic engagement and usability study. https://clinicaltrials.gov/ct2/show/study/NCT04326231 (2020).
51. A remote, decentralized opioid use disorder study to evaluate patient engagement with a game-based digital therapeutic. https://clinicaltrials.gov/ct2/show/NCT04542642.
52. Orion Corporation, Orion Pharma. DTx for pain: behavioural revalidation in augmented and virtual reality for chronic pain; and exploratory pilot study of a virtual reality software. https://clinicaltrials.gov/ct2/show/NCT04225884 (2020).
53. University College, London. Digital interventions in neuro-rehabilitation: a small scale randomised clinical trial to test a web-based therapy application for people with naming difficulties with mild- moderate dementia (Gotcha!). https://clinicaltrials.gov/ct2/show/NCT04570215 (2020)
54. University College, London. Digital interventions in neuro-rehabilitation (DINR): a digital neuro intervention (DNI) for word retrieval (anomia). https://clinicaltrials.gov/ct2/show/NCT04566081 (2020).
55. Eldridge SM, Lancaster GA, Campbell MJ, et al. Defining feasibility and pilot studies in preparation for randomised controlled trials: development of a conceptual framework. PLoS ONE 2016; 11: e0150205.
57. Roy A, Druker S, Hoge EA, Brewer JA. Physician anxiety and burnout: symptom correlates and a prospective pilot study of App-delivered mindfulness training. JMIR Mhealth Uhealth 2020; 8: e15608.
58. Eysenbach G, CONSORT-EHEALTH Group. CONSORT-EHEALT Improving and standardizing evaluation reports of web-based and mobile-health interventions. J Med Internet Res 2011; 13: e126.
59. Evidence standards framework for digital health technologies | Our programmes | What we do | About. NICE https://www.nice.org.uk/about/what-we-do/our-programmes/evidence-standards-framework-for-digital-health-technologies.
60. Endeavour TM. Instruction for use. Akili Interactive Labs. 2020.
61. Berglund Scherwitzl E, Gemzell Danielsson K, Sellberg JA, Scherwitzl R. Fertility awareness-based mobile application for contraception. Eur J Contracept Reprod Health Care 2016; 21: 234-41.
62. Berglund Scherwitzl E, Lundberg O, Kopp Kallner H, et al. Perfect-use and typical-use Pearl Index of a contraceptive mobile app. Contraception 2017; 96: 420-5.
63. Kleinschmidt TK, Bull JR, Lavorini V, et al. Advantages of determining the fertile window with the individualised Natural Cycles algorithm over calendar-based methods. Eur J Contracept Reprod Health Care 2019; 24: 457-63.
64. Bull JR, Rowland SP, Berglund Scherwitzl E, et al. Real-world menstrual cycle characteristics of more than 600,000 menstrual cycles. NPJ Dig Med 2019; 2: 1-8.
65. Berglund Scherwitzl E, Lundberg O, Kopp Kallner H, et al. Short- and long-term effect of contraceptive methods on fecundity. Eur J Contracept Reprod Health Care 2019; 24: 260-5.
66. Torous J, Andersson G, Bertagnoli A, et al. Towards a consensus around standards for smartphone apps and digital mental health. World Psichiatry 2019; 18: 97-8.



